
科目: 来源: 题型:选择题
| A. | W、Y、Z三种元素的最高价氧化物的水化物可能有两种是强碱、一种是强酸 | |
| B. | Z元素在第3周期第ⅥA族 | |
| C. | W、Y、Z三种元素有两种是金属、一种是非金属 | |
| D. | W、X、Y三种元素最高价氧化物对应水化物的碱性依次增强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用电子式表示氯化氢分子的形成过程: | |
| B. | 一定条件下从正反应开始的某可逆反应达到化学平衡时,正反应速率降到最小 | |
| C. | 酸与碱发生中和反应时放出的热量叫中和热 | |
| D. | 催化剂不但能改变反应速率,也能改变反应进行的限度 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | K电子数比L层电子数少4个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
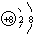 .写出元素Z的气态氢化物的电子式
.写出元素Z的气态氢化物的电子式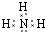 (用元素符号表示)
(用元素符号表示)查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
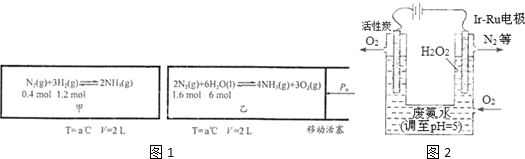
查看答案和解析>>
科目: 来源: 题型:解答题
 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$
 $→_{②Zn/H_{2}O}^{①O_{3}}$
$→_{②Zn/H_{2}O}^{①O_{3}}$
 .
. ;该反应类型酯化反应
;该反应类型酯化反应
查看答案和解析>>
科目: 来源: 题型:解答题

| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com