
科目: 来源: 题型:选择题
| A. | 盖斯定律为我们提供了解决很难由实验直接测定而获得反应热的理论依据 | |
| B. | 若用50mL 0.50mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.25mo1•L-1的硫酸充分反应,两反应测定的反应热不相等 | |
| C. | 实验时只需要记录反应体系的最高温度t即可 | |
| D. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,再用环形玻璃搅拌棒不断搅拌 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| B. | 用锡焊接的铁质器件,焊接处易生锈 | |
| C. | 在铁制品上镀铜时,镀件(待镀金属)为阳极,铜盐为电镀液 | |
| D. | 铁制钥匙表面镀上一层锌,钥匙不易被腐蚀 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 | |
| B. | 图②装置的盐桥中KCl的Cl-移向甲烧杯 | |
| C. | 图③装置中钢闸门应与外接电源的负极相连以获得保护 | |
| D. | 图④两个装置中通过导线的电流相同时(忽略电阻和其它能量损耗),消耗负极材料的质量相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 温度升高 | B. | 该反应熵增 | ||
| C. | 熵增效应大于能量效应 | D. | 反应速率加快 |
查看答案和解析>>
科目: 来源: 题型:填空题
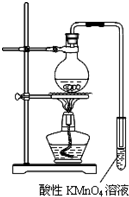 某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $\stackrel{醇△}{→}$CH2=CH2↑+NaBr+H2O
某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $\stackrel{醇△}{→}$CH2=CH2↑+NaBr+H2O查看答案和解析>>
科目: 来源: 题型:填空题
 ,B为18电子分子,其结构式为
,B为18电子分子,其结构式为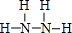 .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| M | N | ||
| X | Y |
| A. | X位于三周期 IIA,其单质可采用电解熔融MgCl2制备 | |
| B. | 元素最高价氧化物的水化物中,酸性最强的是HNO3 | |
| C. | 气体分子(MN)2 的电子式为 | |
| D. | (MN)2其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=2NaCN+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锗酸(化学式为H4GeO4),是难溶于水的弱酸 | |
| B. | ①硫酸比次氯酸稳定;②S2-易被氯气氧化,均能说明氯元素的非金属性比硫元素强 | |
| C. | 中学教材所附周期表中第15列元素的最高价氧化物对应水化物的化学式均为H3RO4 | |
| D. | HF的沸点比HCl 高,是因为H-F键比H-Cl键强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com