
科目: 来源: 题型:解答题
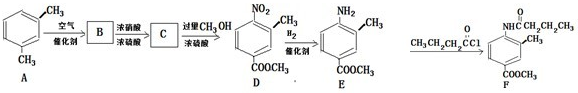
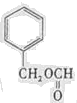
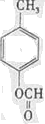
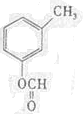
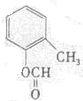 (写结构简式).
(写结构简式).查看答案和解析>>
科目: 来源: 题型:选择题
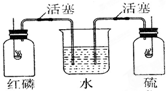 如图所示,红磷和硫磺在两纯氧集气瓶中燃烧,当火焰熄灭时,观察到的现象是( )
如图所示,红磷和硫磺在两纯氧集气瓶中燃烧,当火焰熄灭时,观察到的现象是( )| A. | 水迅速进入甲瓶和乙瓶 | B. | 水不进入甲瓶和乙瓶 | ||
| C. | 水只能进入甲瓶而不能进入乙瓶 | D. | 水只能进入乙瓶而不能进入甲瓶 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 56g N2与12g H2在密闭容器中反应,转移电子的数目为12.0×6.02×1023. | |
| B. | 标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为6.02×1023 | |
| C. | 工业上用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子必为0.5×6.02×1023 | |
| D. | V L a mol•L-1 氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C3N4是分子晶体 | |
| B. | C3N4晶体中微粒通过离子键结合 | |
| C. | C3N4晶体具有导电性和延展性 | |
| D. | C3N4晶体是以C、N原子为基本微粒,共价键为作用力的空间网状结构 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H+、Fe3+、I-、SO42- | B. | Al3+、Mg2+、HCO3-、Cl- | ||
| C. | K+、Ca2+、NO3-、SiO32- | D. | K+、Na+、OH-、AlO2- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 为测定某NaOH溶液的浓度,通常用已润洗的酸式滴定管放出25.00mL标准盐酸溶液于锥形瓶中,加2滴酚酞,然后向已润洗的碱式滴定管中注入未知浓度的NaOH溶液进行滴定 | |
| B. | 用无水CuSO4 、BaCl2溶液、稀盐酸、NaOH溶液、红色石蕊试纸、KSCN溶液、新制氯水等试剂可确定摩尔盐的化学式 | |
| C. | 通常采用产生气泡的快慢,来比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 | |
| D. | 萃取操作所用的分液漏斗使用前应加入少量水,见旋塞芯处是否漏水,待确认不漏水后则可以使用 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若Va=Vb,则混合后溶液PH=7 | |
| B. | 若Va<Vb,则混合后溶液PH一定大于7 | |
| C. | 若Va=Vb,则CH3COOH与NaOH完全中和 | |
| D. | 若Va=Vb,混合的溶液中微粒浓度关系可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{{O}_{3}}^{-})}$=$\frac{1}{2}$ | |
| B. | 参加反应的氯气的物质的量小于$\frac{1}{2}$a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改变温度,产物中KC1O3的最大理论产量为$\frac{1}{7}$a mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com