
科目: 来源: 题型:选择题
 光气的分解反应为:COCl2(g)?Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是( )
光气的分解反应为:COCl2(g)?Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是( )| A. | 从第10min到第12min时,生成Cl2的速率v(Cl2)=0.01mol•L-1•min-1 | |
| B. | 第8min时与第18min时反应的平衡常数相同 | |
| C. | 由于10min时条件的改变,使COCl2的转化率降低 | |
| D. | 在第14min时,改变的条件可能是压缩反应容器的体积 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 四种元素的原子半径:r(Z)>r(X)>r(Y)>r(W) | |
| B. | X、Y、Z、W形成的单质最多有6种 | |
| C. | 四种元素均可与氢元素形成18电子分子 | |
| D. | 四种元素中.Z的最高价氧化物对应水化物酸化最强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子式为C10H1202的有机物,①苯环上有两个取代基,②能与NaHCO3反应生成气体,满足以上2个条件的该有机物的同分异构体有15种 | |
| B. | 分子式为C4H8Cl2机物,只含有一个甲基的同分异构体有7种 | |
| C. | 分子式为C4H10O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | h1>h2>h3>h4 | B. | h4>h3>h2>h1 | C. | h4>h1>h3>h2 | D. | h2>h3>h1>h4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 绪论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液NO3-被Fe2+还原为NO2 |
| B | 溴乙烷中加入氢氧化钠溶液加热充分反应后,滴入硝酸银溶液 | 产生浅黄色沉淀 | 溴乙烷中含有溴元素 |
| C | 在0.1mol•L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 向含有硫酸钡沉淀的溶液加入浓碳酸钠溶液,充分搅拌后过滤、洗涤,在滤渣中加入盐酸 | 产生无色无味气体 | Ksp(BaSO4)>Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 有机物X的含氧官能团有3种 | |
| B. | X分子中苯环上的一氯取代物有3种 | |
| C. | 在Ni作催化剂的条件下,1mol X 最多能与5 mol H2加成 | |
| D. | X在一定条件下能发生加成、取代、消去等反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将SO2气体通入NaClO溶液中:SO2+ClO-+H2O=SO32-+2HClO | |
| B. | 向FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | 三氯化铝溶液与足量的氨水反应:Al3++4OH-=[Al(OH)4]- | |
| D. | 用三氯化铁溶液腐蚀铜印刷电路板:2Fe3++Cu=Cu2++2Fe2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢化物的稳定性Y<Z<W | |
| B. | Y的单质常用来制造光导纤维 | |
| C. | W的单质可作为水处理中的消毒剂 | |
| D. | X的最高价氧化物对应的水化物可与W的单质发生反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
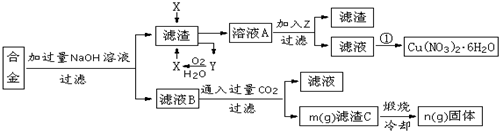
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com