
科目: 来源: 题型:选择题
| A. | 铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应 | |
| B. | 棉布,羊毛和绦纶燃烧后都生成二氧化碳和水 | |
| C. | 航天飞机上的陶瓷防护片属于新型无机非金属材料 | |
| D. | 食品保鮮膜、塑料水杯等生活用品的主要成分是聚氯乙烯 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 编 号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L(标准状况下) | 2.24L | 4.48L | 6.72L | V |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 键能:C≡C>C=C>C-C | B. | 键长:C-C>C=C>C≡C | ||
| C. | 沸点:C5H8>C4H6>C3H4 | D. | 分子活性:C2H6>C2H4>C2H2 |
查看答案和解析>>
科目: 来源: 题型:填空题
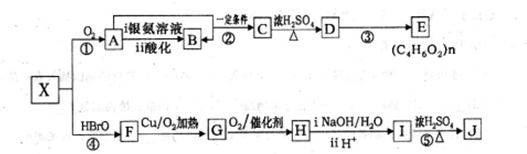

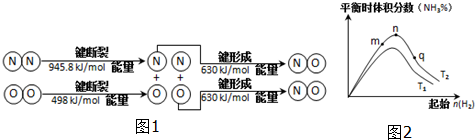
 .
. 查看答案和解析>>
科目: 来源: 题型:填空题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
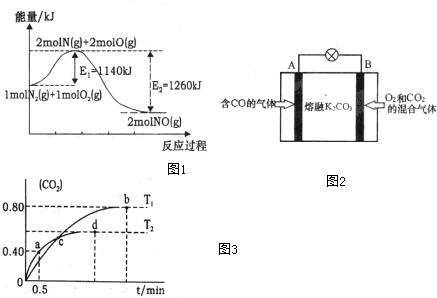
查看答案和解析>>
科目: 来源: 题型:填空题
| 硼镁矿 | 硼砂 | 硼酸 | 偏硼酸钠 |
| Mg2B2O5•H2O | Na2B4O7•10H2O | H3BO3 | NaBO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
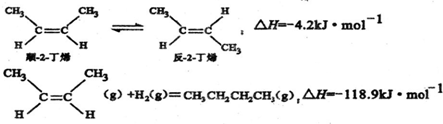
| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯小 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: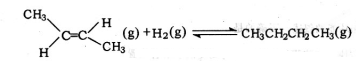 △H=-123.1kJ•mol-1 △H=-123.1kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 6.4g由S2、S4、S8组成的混合物中所含硫原子数为0.2NA | |
| B. | 用100ml 4mol/L盐酸与8.7g MnO2供热能制取氯气4.48L | |
| C. | 一定温度下,0.1L 0.1mol/L的CH3COOH溶液和1L 0.01mol/L 的CH3COOH溶液所含CH3COO-的数目均为0.01NA | |
| D. | 一定条件下,将1mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 银氨溶液或新制Cu(OH)2均能检验糖尿病人尿液中的葡萄糖 | |
| B. | 在燃煤中加入适量生石灰,可以减少二氧化硫的排放 | |
| C. | 铜制品在潮湿环境中的腐蚀比干燥环境中快 | |
| D. | 生活中的水杯、奶瓶、食物保鲜膜等可以使用聚氯乙烯来制造 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com