
科目: 来源: 题型:选择题
| A. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| B. | 0.1mol白磷(P4)所含的共价键数目为0.4 NA | |
| C. | 在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为7NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| 操 作 | 现 象 | 结 论 | |
| A | 向某溶液中滴加BaCl2溶液和稀HNO3 | 产生白色沉淀 | 溶液中一定含有SO42- |
| B | 淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 | 产生红色沉淀 | 淀粉水解可生成葡萄糖 |
| C | 向盛有0.5mol•L-1Fe(NO3)2溶液的试管中加入0.5mol•L-3H2SO4溶液 | 在试管口处现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| D | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液呈紫色 | 原溶液中有I- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH2.H2O | |
| B. | 高锰酸钾酸性溶液吸收二氧化硫:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ | |
| C. | Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| D. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 海水、氯水、氨水均为混合物 | |
| B. | SiO2不能和水反应,所以它不是酸性氧化物 | |
| C. | 液氨、液态氯化氢都是非电解质 | |
| D. | 冰、干冰、冰醋酸都是电解质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加碘食盐能使淀粉溶液变蓝 | |
| B. | PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物属于胶体 | |
| C. | 装饰装修材料中的甲醛、芳香烃及放射性物质都会造成室内污染 | |
| D. | 煤经过气化和液化两种物理变化,可变为清洁能源 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |
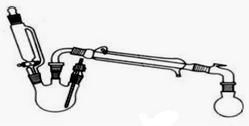
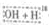 OCH2CH3$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O
OCH2CH3$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O
 后消去失水,失水有两种可能分别生成
后消去失水,失水有两种可能分别生成 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D、E是原子序数依次递增的短周期元素,A+无电子,BD与C2是等电子体,第一电离能:C>D>B,D和E同主族,ED2是形成酸雨的主要危害气体,F元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
A、B、C、D、E是原子序数依次递增的短周期元素,A+无电子,BD与C2是等电子体,第一电离能:C>D>B,D和E同主族,ED2是形成酸雨的主要危害气体,F元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.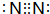 ,E属于元素周期表中ds区
,E属于元素周期表中ds区查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 11.2L<a<22.4L | |
| B. | 若a=16.8L,V(N2O4)=5.6L | |
| C. | 若a=16.8L,n(NaNO2):n(NaNO3)=4:1 | |
| D. | 若混合气体与NaOH溶液反应只生成一种盐,则n(NO)=0.5mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CuSO4溶液、稀豆浆、硅酸都能产生丁达尔效应 | |
| B. | 将NaAlO2溶液蒸干后灼烧,所得固体产物为Al2O3 | |
| C. | 标准状况下,22.4L二氯甲烷中含σ键的数目为2.408×1024 | |
| D. | 室温下,7.0g乙烯和丁烯的混合气体中含有氢原子的数目为6.02×1023 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 水电离出的c(H+)>10-7mol/L | |
| B. | c(Al3+)=c(NH4+)+c(NH3•H2O) | |
| C. | Ca2+、HCO3-、Na+、Cl-能在该溶液中大量共存 | |
| D. | 向该溶液中滴加10mL0.1mol/L NaOH溶液,无沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com