
科目: 来源: 题型:解答题
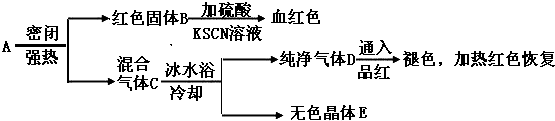
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  如图的键线式表示烃的名称为:3-甲基-4-乙基-7-甲基辛烷 | |
| B. | 符合分子式为C3H8O的醇有三种不同的结构 | |
| C. | 乙烯在一定条件下能发生加成反应,加聚反应,被酸化高锰酸钾溶液氧化,也能在一定条件下被氧气氧化成乙酸 | |
| D. |  治疗疟疾的青蒿素(如图),分子式是C15H20O5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯、乙醇、四氯化碳都是重要有机溶剂,都可用于提取碘水中的碘单质 | |
| B. | 可用蘸浓硫酸的玻璃棒检验输送氨气的管道是否漏气 | |
| C. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 | |
| D. | 用量筒量取10.00mL 1.0mol/L的盐酸于100mL溶量瓶中,加水稀释至刻度,可制得0.1mol/L的盐酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铝和铜常用于导电体,铝被人类大规模开发、使用的时间远超过铜被人类大规模开发和使用的时间 | |
| B. | 使用煤液化的产品作燃料与直接燃烧煤比较,对保护环境有利,目前,煤液化的唯一途径是将煤在高温和催化剂条件下与氢气反应 | |
| C. | 石油分馏的馏分之一是石油气,石油气含有大量的己烷 | |
| D. | 在陶瓷、聚合物中加入固态胶体粒子,可以改进材料的耐冲击强度和耐断裂强度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(B)>r(C)>r(D) | |
| B. | B的简单气态氢化物的热稳定性比D的弱 | |
| C. | E分别与A、C形成的化合物中化学键类型相同 | |
| D. | C的最高价氧化物对应水化物的碱性在同周期中最强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,6.4g O2和O3的混合气体中含有的分子数为0.4 NA | |
| B. | 标准状况下,2.24 L CCl4分子中共价键的数目为0.4NA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有氢氧根离子数为0.1 NA | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
 X、Y、Z、W都是元素周期表中的前四周期元素,它们的核电荷数依次增大.X原子的最外层p轨道的电子为半充满结构,Y是地壳中含量最多的元素.Z元素形成的一种化合物常用作净水剂.W元素是第四周期元素中未成对电子数最多的元素,WCl3能与X、Y的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,1mol配合物与足量的AgNO3溶液反应能生成3molAgCl.请回答下列问题:
X、Y、Z、W都是元素周期表中的前四周期元素,它们的核电荷数依次增大.X原子的最外层p轨道的电子为半充满结构,Y是地壳中含量最多的元素.Z元素形成的一种化合物常用作净水剂.W元素是第四周期元素中未成对电子数最多的元素,WCl3能与X、Y的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,1mol配合物与足量的AgNO3溶液反应能生成3molAgCl.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
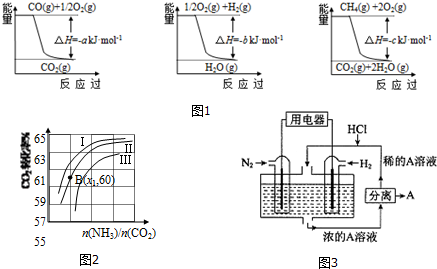
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | c2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 离子半径:X>Y | |
| B. | 氢化物的稳定性:W>Z | |
| C. | 化合物X2W2和Y2W3中都不含共价键 | |
| D. | 1 mol ZW2晶体所含Z-W键的数目为4NA(NA为阿伏加德罗常数的值) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com