
科目: 来源: 题型:选择题
| A. | 易失去电子的物质 | B. | 原子核外有10个电子的微粒 | ||
| C. | 原子的最外层只有1个电子的元素 | D. | 原子核内有12个质子的元素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 熔化的金属铝非常黏稠 | |
| B. | 铝的密度小,所受重力也小 | |
| C. | 大部分铝已经被氧化 | |
| D. | 氧化膜的熔点比铝高,兜住了熔化的铝 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ③④ | B. | ②③ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| B. | HCl、HBr、HI的稳定性依次增强 | |
| C. | 钠、镁、铝的还原性依次减弱 | |
| D. | P、S、Cl最高正价依次降低 |
查看答案和解析>>
科目: 来源: 题型:填空题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ②④⑤ | C. | ③⑤ | D. | ①③④ |
查看答案和解析>>
科目: 来源: 题型:解答题
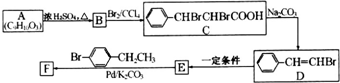
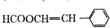 (写结构简式).
(写结构简式).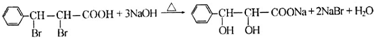
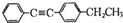 .
.查看答案和解析>>
科目: 来源: 题型:解答题
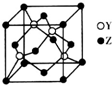 X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题:
X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com