
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
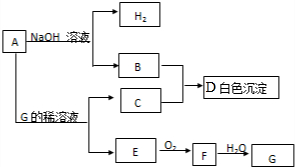
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 9.6g | B. | 6.4g | C. | 3.2g | D. | 1.6g |
查看答案和解析>>
科目: 来源: 题型:选择题
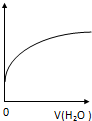
| A. | CH3COO-水解常数 | B. | 溶液中CH3COOH的数目 | ||
| C. | 溶液的PH | D. | 溶液中CH3COO- 的浓度 |
查看答案和解析>>
科目: 来源: 题型:解答题
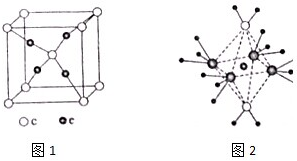 周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子,回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子,回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NCl3分子中N-Cl键的键长比CCl4分子中C-Cl键的键长长 | |
| B. | NCl3分子是非极性分子 | |
| C. | 分子中的所有原子均达到8电子稳定结构 | |
| D. | NCl3不含孤电子对 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com