
科目: 来源: 题型:解答题
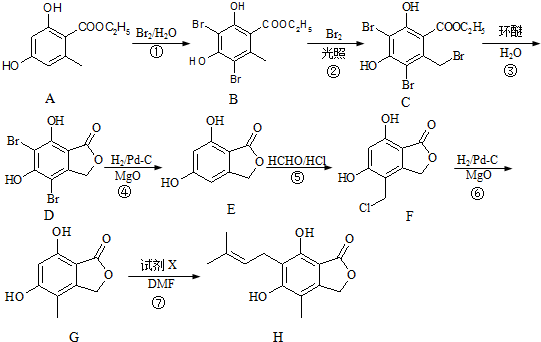
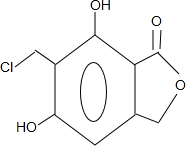 (任写一种).
(任写一种).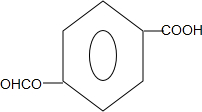 .
.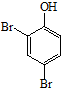 、HCHO为原料制备
、HCHO为原料制备 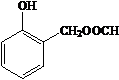 合成路线流程图(无机试剂任用).合成路线流程图示例如下:
合成路线流程图(无机试剂任用).合成路线流程图示例如下: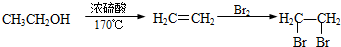
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盐酸中加入浓硫酸 | 产生白雾 | 浓硫酸有吸水性 |
| B | 向某红色溶液中通入SO2气体 | 红色褪去 | SO2具有漂白性 |
| C | 将乙醇与浓硫酸共热产生的气体通入酸性高锰酸钾溶液中 | 紫红色变浅 | 反应生成乙烯 |
| D | 向碳酸钠溶液中滴加几滴酚酞后,加热 | 红色加深 | 盐类水解是吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
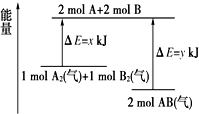
| A. | 该反应是吸收能量的反应 | |
| B. | 断开1 mol A2(气)和1 mol B2(气)中的化学键共放出x kJ热量 | |
| C. | 2 mol AB(气)中的化学键断裂要吸收y kJ热量 | |
| D. | 2 mol AB(气)的总能量大于1 mol A2(气)和1 molB2(气)的总能量 |
查看答案和解析>>
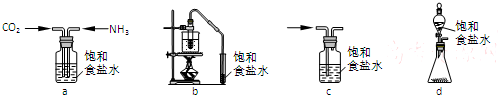
科目: 来源: 题型:填空题
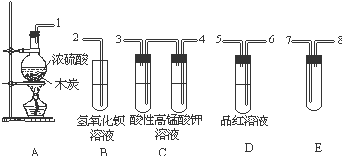 浓H2SO4与炭反应,产物成分可用如图装置来确认:
浓H2SO4与炭反应,产物成分可用如图装置来确认:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
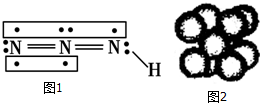 叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.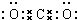 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 硼(B)及其化合物在化学中有重要的地位.请回答下列问题:
硼(B)及其化合物在化学中有重要的地位.请回答下列问题: [B(OH)4]-+H+.
[B(OH)4]-+H+.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com