
科目: 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
 或
或 ;由②、④两种元素形成的一种气体会产生温室效应,其电子式为:
;由②、④两种元素形成的一种气体会产生温室效应,其电子式为: .
.
查看答案和解析>>
科目: 来源: 题型:解答题
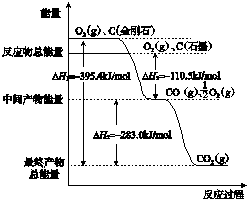
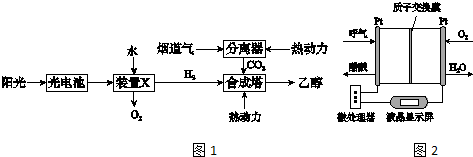
查看答案和解析>>
科目: 来源: 题型:解答题
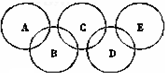 如图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素.A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:
如图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素.A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 ,D在元素周期表中的位置第3周期,第VIA族.
,D在元素周期表中的位置第3周期,第VIA族.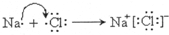 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 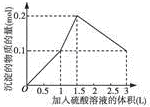 图A表示在1L含0.1mol NaAlO2和0.1mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.11mol•L-1H2SO4溶液,产生沉淀的物质的量与加入硫酸溶液体积的图象 | |
| B. | 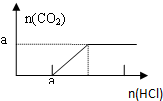 图B表示在分别含amol的Na2CO3和NaOH的混合溶液中逐滴滴加稀盐酸,产生气体 与加入盐酸体积的图象 | |
| C. | 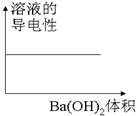 图C表示向100mL 0.1mol/L H2SO4溶液中,逐滴加入0.1mol/L Ba(OH)2溶液至过量, 溶液的导电性与加入 Ba(OH)2溶液体积的图象 | |
| D. | 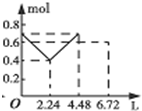 图D表示在往含0.2mol NaOH和0.1mol Ba(OH)2的溶液中持续稳定地通入CO2气体, 溶液中离子数目和通入CO2气体体积的图象(气体的溶解忽略不计) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 150mL | B. | 200mL | C. | 450mL | D. | 无法计算 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X位于元素周期表中第2周期ⅤA族 | |
| B. | X元素有-3、+5两种化合价 | |
| C. | X元素在元素周期表中的族序数肯定为奇数 | |
| D. | X元素最高价氧化物对应的水化物可以表示为H3XO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A. | 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 | |
| B. | 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 | |
| C. | 若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用 | |
| D. | 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为:甲<丙<戊 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑥ | C. | ③④⑤ | D. | ②④⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第n周期的最后一种金属元素处在第n-1族(1<n<7,n为正整数) | |
| B. | m=1和m=7(m为最外层电子数)的元素单质能形成的化合物都是离子化合物 | |
| C. | m-n=5(m为最外层电子数,n为电子层数)的主族元素存在最强的对应含氧酸 | |
| D. | 第n周期有n种主族金属元素(1<n<7,n为正整数) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com