
科目: 来源: 题型:选择题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 一段时间内生成1 mol O2(g)同时生成1 mol SO3(g),说明反应达到平衡 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
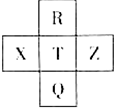 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:X<T<Q | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 简单离子的还原性:T>Q |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律 | |
| B. | IA族与ⅦA族元素间可形成离子键也可形成共价键 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应可以设计成原电池来提供电能 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 正极反应式:Ca+2Cl--2e-=CaCl2 | |
| B. | 放电过程中,OH-向负极移动 | |
| C. | 放电时,电流由钙电极流向硫酸铅电极 | |
| D. | 常温时,在正负极间接上电流表或检流计,指针不偏转 |
查看答案和解析>>
科目: 来源: 题型:填空题
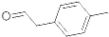
 是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(
是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(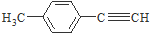 )的一条路线如下:
)的一条路线如下: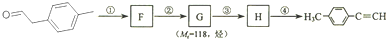
 分子中一定在同一平面的原子数为12个;
分子中一定在同一平面的原子数为12个; 分子中在同一直线上的原子数最多有6个;
分子中在同一直线上的原子数最多有6个;| 序号 | 所加试剂及反应条件 | 反应类型 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目: 来源: 题型:填空题
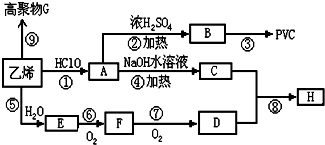
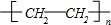 ;
;查看答案和解析>>
科目: 来源: 题型:填空题

 ;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1.
;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1. .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50 mL 0.50 mol•L-1 NaOH溶液 | 50 mL 0.55 mol•L-1 HCl溶液 | 20℃ | 23.2℃ | |
| ② | 50 mL 0.50 mol•L-1 NaOH溶液 | 50 mL 0.55 mol•L-1 HCl溶液 | 20℃ | 23.4℃ | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com