
科目: 来源: 题型:选择题
| A. | 强酸性溶液中:K+、Fe2+、Cl-、NO3- | |
| B. | 强碱溶液中:Na+、K+、[Al(OH)4]-、CO32- | |
| C. | 强碱性溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 所含质子数和电子数相等的微粒一定是原子 | |
| B. | 两种微粒如果核外电子排布相同,化学性质就一定相同 | |
| C. | 质量数相同的原子其化学性质一定相同 | |
| D. | 具有相同核电荷数的原子或单核离子一定是同种元素 |
查看答案和解析>>
科目: 来源: 题型:解答题
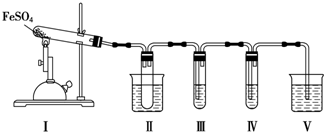
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中装有0.5mol•L-1BaCl2溶液 | 产生大量白色沉淀,证明气体产物中含有SO3 |
| 装置Ⅳ的试管中装有0.01mol•L-1酸性KMnO4溶液(或0.0l mol.L-1 溴水) |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
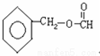
.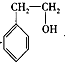 +CH3COOH$?_{△}^{浓硫酸}$
+CH3COOH$?_{△}^{浓硫酸}$ +H2O.
+H2O. 、、
、、 、
、 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| W | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
| X | 常见的金属,在周期表中的周期序数与族序数相等 |
| Y | 气态氢化物及其最高价氧化物对应的水化物均为强酸 |
| Z | 其原子质量数为56,中子数为30的核素 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| B. | pH相同的①CH3COONa、②NaHCO3、③ 三份溶液中的c(Na+):③>②>① 三份溶液中的c(Na+):③>②>① | |
| C. | 图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 图中V(CH3COOH)>20mL,溶液pH<7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 弱酸 | H2CO3 | 水杨酸(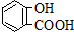 ) ) |
| 电离平衡常数(925℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-11 |
| A. | 常温下,等浓度、等体积的NaHCO3溶液pH小于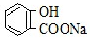 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2CO3溶液和 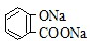 溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. |  +2NaHCO3→ +2NaHCO3→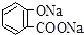 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1的原因之一是能形成分子内氢键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验目的 | 玻璃仪器 |
| A | 验证Na2CO3和NaHCO3的热稳定性 | 酒精灯、试管、导气管、烧杯 |
| B | 用碱石灰除去氢气中混有的水蒸气并收集氢气 | 洗气瓶、导气管、集气瓶 |
| C | 用氢氧化钠和醋酸溶液测中和反应的中和热 | 烧杯、玻璃棒、温度计 |
| D | 分离苯和苯酚的混合物 | 分液漏斗、烧杯 |
| A. | A | B. | B | C. | C | D. | .D |
查看答案和解析>>
科目: 来源: 题型:解答题

| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com