
科目: 来源: 题型:选择题
| A. |  根据用电器(G)中指针的偏转方向可比较Zn、Cu的金属的氧化性 | |
| B. |  根据右侧小试管中液面的变化,可以判断铁钉发生了析氢腐蚀 | |
| C. |  测定中和热 | |
| D. |  根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断2NO2(g)?N2O4(g)是一个放热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全灭活该病毒感染性,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | 从硫酸亚铁铵溶液中获取硫酸亚铁铵晶体,可以用蒸发结晶,也可以用冷却结晶 | |
| C. | iPhone6外壳易掉色是因为铝壳表面氧化处理过程中作为阳极的金属铝纯度不够 | |
| D. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]溶液,观察铁钉周围出现蓝色沉淀的快慢 |
查看答案和解析>>
科目: 来源: 题型:解答题

| Fe3+ | Co2+ | Co3+ | Al2+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目: 来源: 题型:解答题
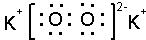 ;
;查看答案和解析>>
科目: 来源: 题型:填空题
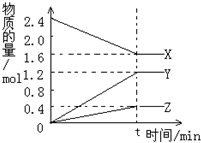 (1)拆开1mol H-H键,1mol N-H键,1mol N三N键分别需要吸收的能量为436kJ,391kJ,946kJ,则理论上,每生成1mol NH3放出(填:吸收或放出)热量46 kJ;
(1)拆开1mol H-H键,1mol N-H键,1mol N三N键分别需要吸收的能量为436kJ,391kJ,946kJ,则理论上,每生成1mol NH3放出(填:吸收或放出)热量46 kJ;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(A)=0.3 mol/(L•min) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v(A)=0.01 mol/(L•s) | D. | v(C)=0.5 mol/(L•min) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.44 s | B. | 2 s | C. | 0.33 s | D. | 1 s |
查看答案和解析>>
科目: 来源: 题型:填空题
 ,可先向溶液中加入足量的银氨溶液加热,充分反应后,再加入足量的溴水.
,可先向溶液中加入足量的银氨溶液加热,充分反应后,再加入足量的溴水.查看答案和解析>>
科目: 来源: 题型:填空题
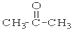 ③CH3CH2Br ④
③CH3CH2Br ④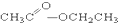 ⑤
⑤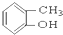 ⑥
⑥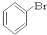 ⑦
⑦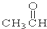 ⑧
⑧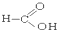 ⑨
⑨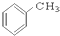 ⑩
⑩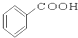
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com