
科目: 来源: 题型:选择题
| A. | 碳酸钙受热分解 | |
| B. | 灼热的木炭与CO2的反应 | |
| C. | 铝粉与四氧化三铁反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:X>Y>Z | B. | 原子序数:X<Y<Z | ||
| C. | 气态氢化物稳定性:X<Y<Z | D. | 非金属性:X>Y>Z |
查看答案和解析>>
科目: 来源: 题型:填空题
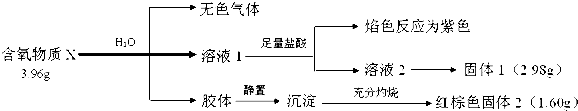
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
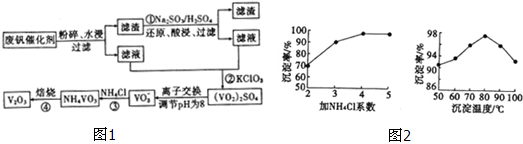
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
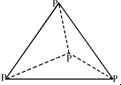 ,打破1mol P-Cl键吸收b kJ的热量,打破1mol Cl-Cl键吸收c kJ的热量.下列叙述正确的是( )
,打破1mol P-Cl键吸收b kJ的热量,打破1mol Cl-Cl键吸收c kJ的热量.下列叙述正确的是( )| A. | 1 mol P4(g)和1 mol Cl2(g)所具有的能量和大于1 mol PCl3(g) 所具有的能量 | |
| B. | 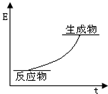 该反应的能量图象可表示 该反应的能量图象可表示 | |
| C. | 形成1mol P-P键放出-($\frac{a}{6}$-2b+c) kJ的热量 | |
| D. | 因为该反应为放热反应,故不需要任何条件就能快速进行 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硒元素的非金属性比溴元素的弱 | |
| B. | 硒的最高价氧化物的水化物的分子式为:H2SeO3 | |
| C. | 硒在周期表中位于第五周期VIA族 | |
| D. | 硒的气态氢化物的稳定性比硫化氢强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com