
科目: 来源: 题型:选择题
| A. | CH3-CH═CH2与 | B. | 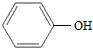 与 与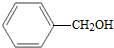 | ||
| C. | CH3COOCH3与CH3CH2COOCH3 | D. | CH3CH2Cl与CH3CHCl-CH2Cl |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | 操作及现象 |
| ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
| 实验序号 | 操作、现象 |
| ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; 另一份滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解 |
| ⅳ | 取2mL 0.1mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2, 无明显变化.再加入H2O2溶液,红色很快褪去 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ (CO)=0.6 mol/(L•min) | |
| B. | 4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2 | |
| C. | 若升高温度,反应的平衡常数变为1.0,则正反应为放热反应 | |
| D. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极a移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属钠在空气中加热,生成淡黄色固体:2Na+O2═Na2O2 | |
| B. | 向硫酸铝溶液中加入氨水制备氢氧化铝:Al3++3NH3•H2O=Al(OH)3↓+3$N{{H}_{4}}^{+}$ | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O=Fe3O4+H2↑ | |
| D. | 二氧化氮溶于水有硝酸生成:3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| C. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
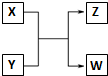 已知X、Y、Z、W分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且X是一种含有18电子的微粒,Z是一种含有10电子的微粒.请回答下列问题:
已知X、Y、Z、W分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且X是一种含有18电子的微粒,Z是一种含有10电子的微粒.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 和
和
 和
和
 和
和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com