
科目: 来源: 题型:解答题
 化学实验有助于理解化学知识,提升科学素养.某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究.
化学实验有助于理解化学知识,提升科学素养.某学习小组在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关探究.查看答案和解析>>
科目: 来源: 题型:解答题
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
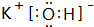 ,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4
,最高价氧化物的水化物酸性最强的酸是HClO4;氢化物稳定性最差的是CH4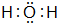 ;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.
;该氢化物在常温下跟B发生反应的化学方程式是2K+2 H2O=2KOH+H2↑,剧烈程度大于(填大于、小于、等于)A.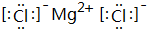 ,用电子式表示其形成过程为
,用电子式表示其形成过程为 .
.查看答案和解析>>
科目: 来源: 题型:解答题
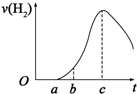 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2为0.3 mol•L-1、O2为0.2 mol•L-1 | |
| B. | SO3SO2各为0.15 mol•L-1 | |
| C. | O2为0.05 mol•L-1 | |
| D. | SO3为0.3 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,反应就完全停止了,即正逆反应速率为零 | |
| C. | 温度越高反应速率越快,平衡时生成的SO3越多 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
查看答案和解析>>
科目: 来源: 题型:选择题
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如图所示,下列说法一定正确的是( )| A. | 最高价氧化物对应水化物的酸性最强的是W | |
| B. | Y与Z只能形成一种化合物 | |
| C. | 简单阴离子还原性:Y>W | |
| D. | Z与Q形成的化合物可能含共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在2 min末的反应速率,用B表示是 0.3 mol/(L•min) | |
| B. | 用A表示的反应速率是0.4 mol/(L•min) | |
| C. | 若乙容器中也同时进行此反应,且相同时间段内用D表示的速率是0.2 mol/(L•min),则乙容器中反应速率更快 | |
| D. | 对甲容器升高温度,则正反应速率将减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属元素和非金属元素间形成的化学键一定是离子键 | |
| B. | 伴有能量变化的物质变化不一定是化学变化 | |
| C. | 可逆反应达到化学平衡时,正逆反应速率都为0 | |
| D. | 通过化学变化可以实现1H与2H间的相互转化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知C+CO2═2CO是吸热反应,当温度升高时,v正增大,v逆减少 | |
| B. | 两个非金属原子之间形成的化学键一定是共价键 | |
| C. | 含有离子键的物质不可能是单质 | |
| D. | 单质中不一定含有共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铝片与稀盐酸的反应 | B. | Ca(OH)2与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 甲烷在氧气中的燃烧反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com