
科目: 来源: 题型:填空题
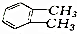 ⑥CH3CH2CH2CH(CH3)C2H5
⑥CH3CH2CH2CH(CH3)C2H5 ⑧
⑧ ⑨
⑨
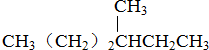
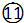 O2
O2 ${\;}_{17}^{35}$Cl
${\;}_{17}^{35}$Cl 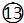 O3
O3 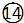 ${\;}_{17}^{37}$Cl
${\;}_{17}^{37}$Cl  ;
; ;
; .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 能发生加聚反应生成高分子化合物 | B. | 该物质与HCl加成产物只一种 | ||
| C. | 具有多种同分异构体 | D. | 可与强酸反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
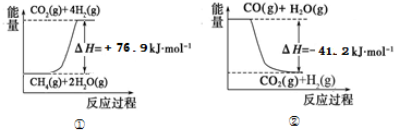
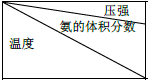 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
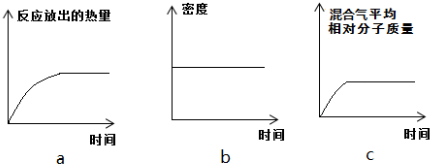
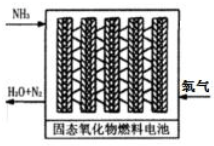
查看答案和解析>>
科目: 来源: 题型:多选题
| A. |  如图装置可用于制备乙酸乙酯 | |
| B. |  如图装置可用于模拟海水蒸馏 | |
| C. |  如图装置可用于探究碳酸氢钠的热稳定性 | |
| D. |  如图装置为配制溶液过程中的定容操作 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 保存硫酸亚铁溶液时,向其中加入铁钉和少量硫酸 | |
| B. | 少量金属钠保存在煤油中 | |
| C. | 少量液溴可用水封存,防止溴挥发 | |
| D. | 浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | +1,+3 | B. | +3,+1 | C. | +2,+3 | D. | +3,+2 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com