
科目: 来源: 题型:选择题
| 序号 | 实验装置 | 实验目的 |
| A | 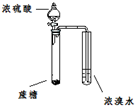 | 证明浓硫酸具有脱水性、氧化性 |
| B | 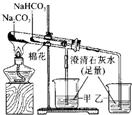 | 比较碳酸钠与碳酸氢钠固体的热稳定性 |
C | 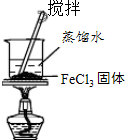 | 制取少量的Fe(OH)3胶体 |
| D | 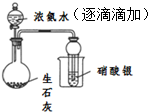 | 证明浓氨水与生石灰作用可制备得到氨气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+=2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH-=CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 长期过量服用阿司匹林出现水杨酸( )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: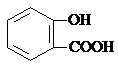 +HCO3-→ +HCO3-→ +CO2↑+H2O +CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 油脂发生皂化反应能生成甘油 | |
| B. | 蛋白质溶液遇醋酸铅溶液发生盐析 | |
| C. | 氨基酸、二肽、蛋白质均既能跟强酸反应又能跟强碱反应 | |
| D. | 乙二醇、甲醛、α-羟基丙酸(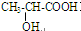 )都可发生缩聚反应 )都可发生缩聚反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaNO2是氧化剂 | B. | N2的电子式是 | ||
| C. | 生成1 mol N2时转移6 mol 电子 | D. | 氧化剂和还原剂的质量之比是1:1 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
 Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.查看答案和解析>>
科目: 来源: 题型:解答题
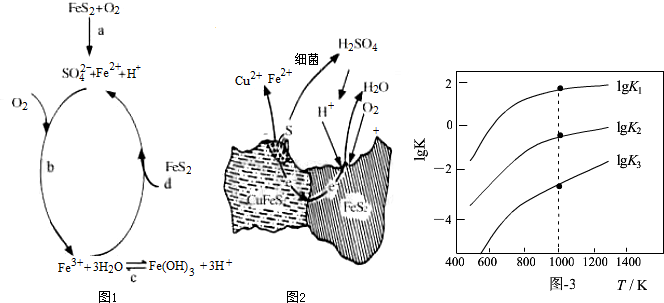
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
科目: 来源: 题型:解答题
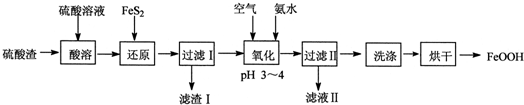
查看答案和解析>>
科目: 来源: 题型:解答题
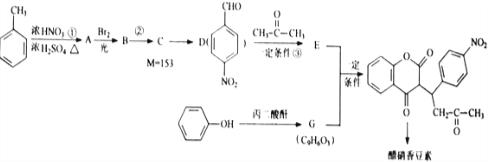
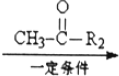 R1-CH=
R1-CH=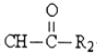 +H2O
+H2O .
.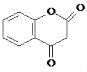 .
.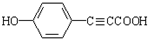 .
.查看答案和解析>>
科目: 来源: 题型:解答题
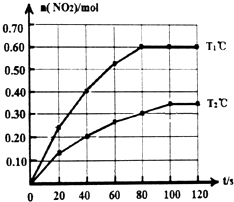 将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H.在Tl℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H.在Tl℃和T2℃时,测得NO2的物质的量随时间变化如图所示:查看答案和解析>>
科目: 来源: 题型:选择题
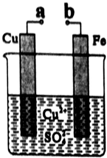
| A. | 无论a和b是否连接,该装置的反应原理相同 | |
| B. | a和b分别连接直流电源正、负极可以实现铁上镀铜 | |
| C. | a和b不连接时反应速率比a和b用导线连接时的速率慢 | |
| D. | 在a、b之间连接一小灯泡,改变Cu2+的浓度不会影响灯泡亮度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com