
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 升高温度 | B. | 加入适量的水 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入浓度较大的硫酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学反应 | 能量转化形式 |
| ①CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | 由 化学能转化为 热能 |
| ②Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O | 由 化学能转化为 电能 |
| ③CaCO3$\frac{\underline{\;高温\;}}{\;}$Ca+CO2↑ | 由 热能转化为 化学能 |
| ④6nH2O+6nCO2$→_{叶绿素}^{光}$(C6H12O6)n+6nO2 | 由 光能转化为 化学能 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 共包含18种元素 | B. | 前3周期元素 | ||
| C. | 除稀有气体外,Cl的原子半径最大 | D. | 仅含5种金属元素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | XY2 | B. | X2Y3 | C. | X2Y | D. | XY |
查看答案和解析>>
科目: 来源: 题型:解答题
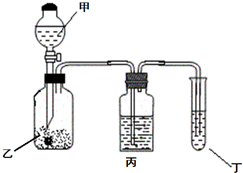 五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
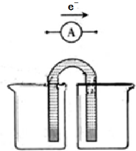 (1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.高铁电池的负极材料是锌,放电时,正极发生还原(填“氧化”或“还原”)反应.
(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.高铁电池的负极材料是锌,放电时,正极发生还原(填“氧化”或“还原”)反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com