
科目: 来源: 题型:解答题
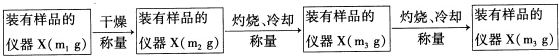
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在0.1 mol•L-1FeCl3溶液中,Na+、NH4+、HCO3-、ClO-一定大量共存 | |
| B. | 常温下,某溶液中由水电离出的c(H+)=1×10-amol•L-1,则该溶液一定pH=a | |
| C. | 相同物质的量浓度下列溶液:①NH4Al(SO4)2;②NH4Cl;③CH3COONH4;④NH3•H2O.其中c(NH4+)由大到小的顺序是①>②>③>④ | |
| D. | AgCl悬浊液中存在如下平衡:AgCl(s)?Ag+(aq)+Cl-(aq).向其中加入少量NaCl晶体,平衡逆向移动,故AgCl溶解度减少,溶度积Ksp也减少 |
查看答案和解析>>
科目: 来源: 题型:解答题
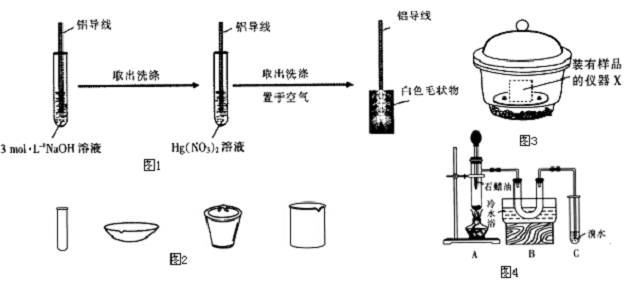
 .
.查看答案和解析>>
科目: 来源: 题型:解答题

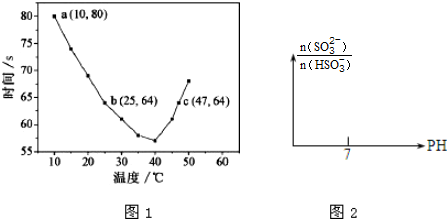
 ,写出气体甲的电子式
,写出气体甲的电子式 .
.查看答案和解析>>
科目: 来源: 题型:解答题
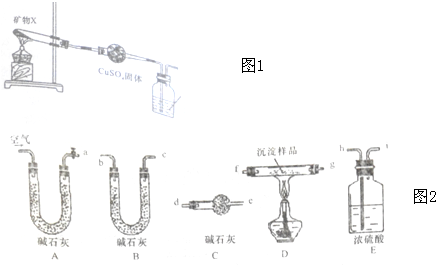
查看答案和解析>>
科目: 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |

查看答案和解析>>
科目: 来源: 题型:选择题
| ①中物质 | ②中物质 | 实验预测 | |
| A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
| B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
| C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
| D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
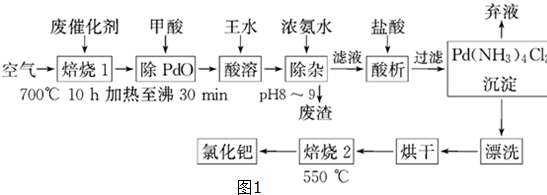
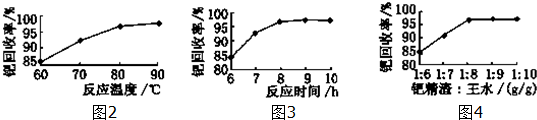
查看答案和解析>>
科目: 来源: 题型:解答题
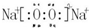 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com