
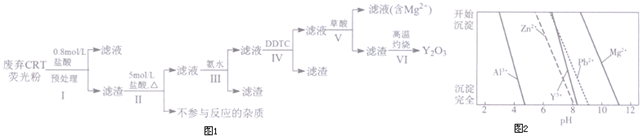
科目: 来源: 题型:解答题
| 成分 含量/% 阶段 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
查看答案和解析>>
科目: 来源: 题型:解答题
 某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.
某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2(g)=$\frac{1}{2}$O2(g)=H2O(I)△H>-241.8kJ•mol-1 | |
| B. | H2的燃烧热△H=-241.8 kJ.mol-1 | |
| C. | H2(g)转变成H2O(g)的化学反应一定放出能量 | |
| D. | CO(g)+H2O(g)=CO2(g)+H2(g)的△H=-41.2kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2 mL 0.5 mol/L硅酸钠溶液中滴入盐酸所制得的硅酸胶体中,含胶粒数目为0.001NA | |
| B. | 8.4 g NaHCO3固体中含有的离子总数为0.3NA | |
| C. | 25℃时,1 L pH=l的CH3COOH溶液中含有H+数目为0.lNA | |
| D. | 7.8 g Na2O2固体中含有的共用电子对数目为0.2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
| 编 号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的+3价Fe被氧化为更高的价态 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 丁 | ? |
| 实验操作 | 预期现象 | 结 论 |
| 说明丁同学的猜想是合理的 |
查看答案和解析>>
科目: 来源: 题型:解答题
 用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步制取 电解二氧化锰(EMD)的工艺流程如下:
用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步制取 电解二氧化锰(EMD)的工艺流程如下: Fe(OH)3+3H+,加入CaCO3后,由于CaCO3(s)
Fe(OH)3+3H+,加入CaCO3后,由于CaCO3(s) Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反应方向移动,Fe3+转化为Fe(OH)3沉淀而被除去.
Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反应方向移动,Fe3+转化为Fe(OH)3沉淀而被除去.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)| 操作 | 现象和结论 |
| ①取一定量2mol/LNaCl溶液,调节溶液pH为4.91;再以相同装置进行电解. ②电解相同时间后,若电极b表面无气泡,取少量阳极附近的溶液, 滴入淀粉KI溶液. | 若溶液不变蓝,证明猜想①不成立 若溶液变蓝,证明猜想①可能成立. |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
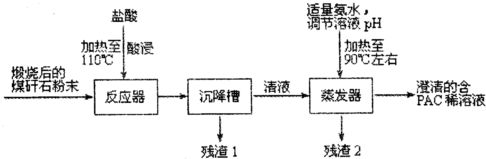
科目: 来源: 题型:解答题

 .
.
 .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com