
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 →
→ .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 63.47 | B. | 64.47 | C. | 63.57 | D. | 64.57 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第三周期ⅥA族 | B. | 第二周期ⅥA族 | C. | 第三周期ⅣA族 | D. | 第二周期ⅣA族 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 化学反应一定有新物质的生成,但不一定有能量的变化 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
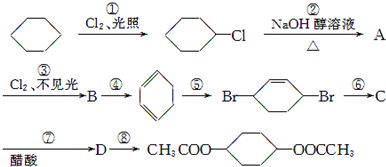
 ,C:
,C: .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaCl+2H2O
+2NaCl+2H2O
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com