
科目: 来源: 题型:填空题


查看答案和解析>>
科目: 来源: 题型:填空题
 过碳酸钠(2Na2CO3•3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,易分解.可用纯碱与H2O2反应制取,反应方程式为:2Na2CO3(aq)+3H2O2(aq)?2Na2CO3•3H2O2(s)△H<0,如图是制取过碳酸钠 的示意图,步骤如下
过碳酸钠(2Na2CO3•3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,易分解.可用纯碱与H2O2反应制取,反应方程式为:2Na2CO3(aq)+3H2O2(aq)?2Na2CO3•3H2O2(s)△H<0,如图是制取过碳酸钠 的示意图,步骤如下查看答案和解析>>
科目: 来源: 题型:解答题
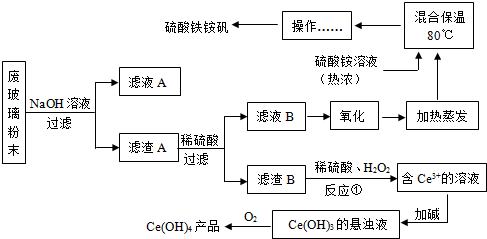

查看答案和解析>>
科目: 来源: 题型:解答题
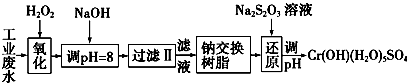
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目: 来源: 题型:解答题
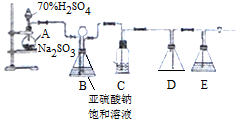

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
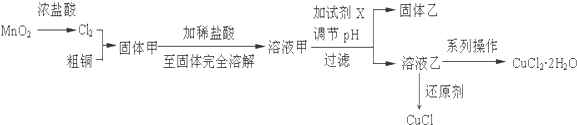
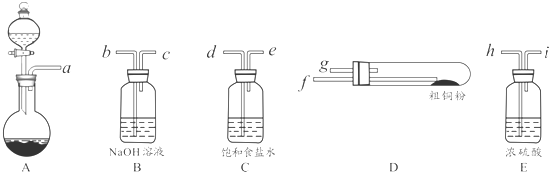
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 ;
; ;25℃、101kPa时该气态氢化物热值为5×104kJ•kg-1,则其标准燃烧热为-1300kJ/mol;
;25℃、101kPa时该气态氢化物热值为5×104kJ•kg-1,则其标准燃烧热为-1300kJ/mol;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com