
科目: 来源: 题型:填空题
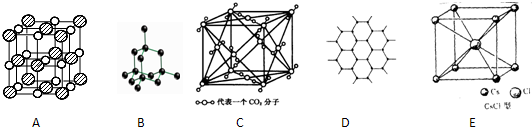
查看答案和解析>>
科目: 来源: 题型:填空题
 以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
| 微粒 | ClO- | ClO2- | ClO3- | ClO4- |
| 立体结构 | 直线 | V型 | 三角锥形 | 正四面体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
| A. | 已知t1>t2,HX的生成反应为放热反应 | |
| B. | 在相同条件下,X2平衡转化率a:F2>Cl2 | |
| C. | X2与H2反应的剧烈程度随着原子序数递增逐渐减弱 | |
| D. | HX的稳定性:HBr>HI |
查看答案和解析>>
科目: 来源: 题型:填空题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
 ;G、H 氢化物的稳定性递减的顺序是HCl>HBr.
;G、H 氢化物的稳定性递减的顺序是HCl>HBr. ;.
;. .
.查看答案和解析>>
科目: 来源: 题型:填空题
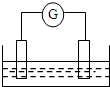 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com