
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
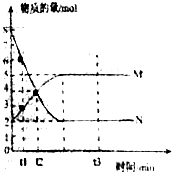 Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子的稳定性与化学键的强弱无关 | |
| B. | 参加反应的氢气和氧气的总能量高于反应生成水的总能量 | |
| C. | 断开参加反应的氢气和氧气中的化学键吸收的能量大于生成水时形成化学键放出的能量 | |
| D. | 该反应需要点燃,所以是吸热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单位时间消耗nmol A,同时生成2nmolC | |
| B. | A,B,C的分子数之比为1:2:3 | |
| C. | A,B,C的浓度相等 | |
| D. | 生成C的速率与分解C的速率相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③ | B. | ①② | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -2 |
| A. | 与稀盐酸反应的剧烈程度:L单质<Q单质 | |
| B. | M与T形成的化合物具有两性 | |
| C. | 热稳定性:H2T<H2R | |
| D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目: 来源: 题型:填空题
 用甲烷、甲醇、乙醇、甲醚等可以制成燃料电池.实验室中,若以甲醇燃料电池为直流电源,以一定浓度的乙醛和 Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其原理是乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,其装置示意图如图所示.
用甲烷、甲醇、乙醇、甲醚等可以制成燃料电池.实验室中,若以甲醇燃料电池为直流电源,以一定浓度的乙醛和 Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其原理是乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,其装置示意图如图所示.查看答案和解析>>
科目: 来源: 题型:填空题
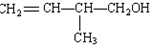
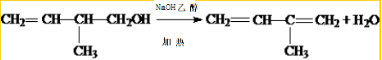 .
.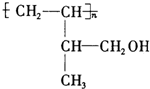 .
.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 由图甲可以判断:对于反应a A (g)+b B (g)?cC (g),若T1>T2,则a+b=c,且△H<0 | |
| B. | 图乙表示温度对可逆反应2A (g)+2 B (g)?3C (g)+D (g)的影响,甲的温度比乙的温度高且正反应为吸热 | |
| C. | 图丙表示可逆反应Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)平衡时,物质的量浓[Fe(SCN)2+]与温度T的关系,反应处于D点时,一定有V(正)>V(逆) | |
| D. | 图丁表示用0.1000mol/L的NaOH溶液滴定20.00ml,0.1000mol/L的醋酸溶液得到的滴定曲线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com