
科目: 来源: 题型:多选题

| A. | 离子半径:M->Z2->Y- | |
| B. | Z元素形成的氧化物都是共价化合物 | |
| C. | 气态氢化物稳定性:Y>Z>M | |
| D. | 三种元素中,M的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子最外层电子数为2的元素一定处于周期表IIA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5 | |
| C. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| D. | 同主族元素形成的氧化物的晶体类型均相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该电池放电时,负极材料为锂,发生还原反应 | |
| B. | 组装该电池可以在有氧的条件下进行 | |
| C. | 电池放电时电子从负极经外电路流向正极,再从正极经电解液流向负极 | |
| D. | 电池充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液可能由pH=3盐酸与pH=11的NH3•H2O溶液等体积混合而成 | |
| B. | 该溶液可能由等物质的量浓度的NH3•H2O与盐酸以2:1的体积比混合 | |
| C. | 该溶液中由水电离出的氢离子浓度一定大于1.0×10-7mol•L-1 | |
| D. | 加入一定量NH3•H2O,c(NH4+)可能大于、等于或小于c(Cl-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 | |
| B. | 醋酸和硬脂酸互为同系物,C2H4和C18H38也互为同系物 | |
| C. | 有机物W(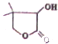 )和其水解产物都可以发生消去反应 )和其水解产物都可以发生消去反应 | |
| D. | 乙烯的加成反应及与酸性KMnO4溶液作用,都与其分子内碳碳双健有关 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向溴水中滴入植物油,振荡后油层仍显无色,因此溴不溶于油脂 | |
| B. | FeCl3溶液可以腐蚀线路板上的Cu,因此Fe的金属活动性大于Cu | |
| C. | 常温下,2NO(g)+O2(g)=2NO2(g),因此该反应△H<0 | |
| D. | 相同浓度的Na2CO3溶液的碱性强于C6H5ONa,因此C6H5OH的酸性强于H2CO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论或解释 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 出现白色沉淀 | 该溶液中一定含有SO42- |
| B | 向浓度均为0.1mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有沉淀产生 | 蛋白质均发生变性 |
| D | 向某溶液中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 该溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 除去瓷器表面污垢可以选用热的烧碱溶液 | |
| B. | 溶质质量分数:医用酒精>食醋>生理盐水 | |
| C. | 绚丽缤纷的烟花是因添加了钾、钠、钙、铜等金属元素的焰色反应形成的 | |
| D. | 研制开发燃料电池汽车,降低机动车尾气污染,某种程度上可以减少PM2.5污染 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的PH值 | 3.2 | 5.2 | 10.4 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com