
科目: 来源: 题型:选择题
| A. | 钠的化学性质很活泼,在自然界里不能以游离态存在 | |
| B. | 化学的特征就是认识分子 | |
| C. | 在化学反应中,参加反应的各物质的质量比等于其物质的量之比 | |
| D. | 俄国化学家门捷列夫提出原子学说,为近代化学的发展奠定了坚实的基础 |
查看答案和解析>>
科目: 来源: 题型:多选题
| 容器编号 | 温度/℃ | 容器体积/L | 平衡时O2转化率 | 平衡时压强/Pa |
| ① | 200 | V1 | 50% | p1 |
| ② | 200 | V2 | 70% | p2 |
| ③ | 350 | V3 | 50% | p3 |
| A. | 起始反应速率:③>①>② | |
| B. | 平衡时压强:p1<p2 | |
| C. | 容器体积:V1<V3 | |
| D. | 若实验②中O2和Cl2用量均加倍,则平衡时O2的转化率小于70% |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
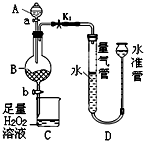 工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).
工业生产中会产生大量的废铁屑,可将其“变废为宝”制成化工原料氯化铁.实验室中利用如图所示装置探究由废铁屑制备FeCl3•6H2O晶体的原理并测定铁屑中铁单质的质量分数(杂质不溶于水且不与酸反应).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AlCl3溶液中通入过量的氨水:Al3++4NH3•H2O=AlO2-+2H2O+4NH4+ | |
| B. | 向NH4HCO3 溶液中加过量NaOH 溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将Cu片加入稀硝酸中:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| D. | 向Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+=SO42-+3S↓+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 加水稀释,电离平衡正向移动,溶液中n(H+)减小 | |
| B. | 加热,电离平衡正向移动,溶液中c(CH3COO-)增大 | |
| C. | 通入少量HCl气体,电离平衡逆向移动,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,电离平衡逆向移动,溶液中c(H+)减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ③>④>①>② | C. | ②>①④>>③ | D. | ④>③>②>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com