
科目: 来源: 题型:解答题
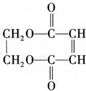 )可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图:
)可用于生产合成树脂、合成橡胶等.以丙烯为原料制备环酯J的合成路线如图: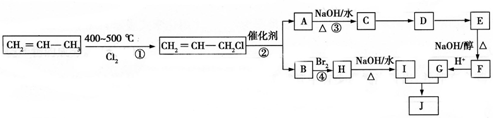
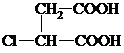 ,G分子中含有的官能团是羧基和碳碳双键(填官能团名称).
,G分子中含有的官能团是羧基和碳碳双键(填官能团名称).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA | |
| B. | 1mol Cl2与足量的铁反应转移的电子数与1mol铁与足量的Cl2反应转移的电子数相等 | |
| C. | 在标准状况下,11.2L NO与11.2L O2混合后所含分子数为0.75NA | |
| D. | 0.5mol•L-1 Na2SO4溶液中含有的阴、阳离子总数为1.5NA |
查看答案和解析>>
科目: 来源: 题型:选择题
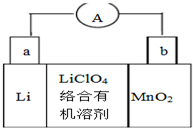 锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池正极反应式为MnO2+e-+Li+=LiMnO2 | |
| C. | 可用水代替电池中的混合有机溶剂 | |
| D. | 每转移0.1mol电子,理论上消耗Li的质量为3.5g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纯碱可用于生产普通玻璃,可用纯碱除去物品表面的油污 | |
| B. | 盐卤点豆腐、明矾净水与胶体的性质有关 | |
| C. | 高温条件下可杀死H7N9型禽流感病毒,属于蛋白质的变性 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子 |
查看答案和解析>>
科目: 来源: 题型:解答题


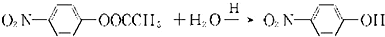 +CH3COOH.
+CH3COOH.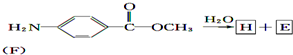
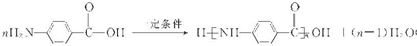 .
.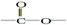 结构.
结构. .
.查看答案和解析>>
科目: 来源: 题型:选择题
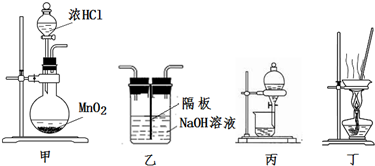
| A. | 用装置甲制取氯气 | |
| B. | 用装置丙分离二氧化锰和氯化锰溶液 | |
| C. | 用装置乙吸收制取氯气的尾气 | |
| D. | 用装置丁蒸干氯化锰溶液制 MnCl2•4H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
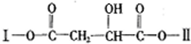 (其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化:
(其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化: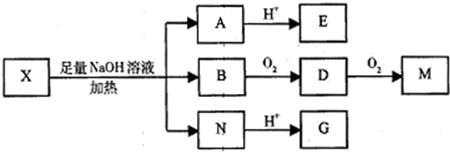
 ;
;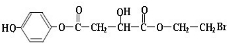 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
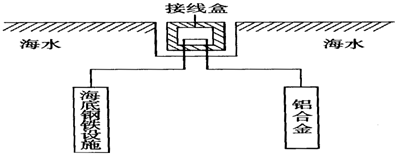
查看答案和解析>>
科目: 来源: 题型:解答题
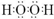 .
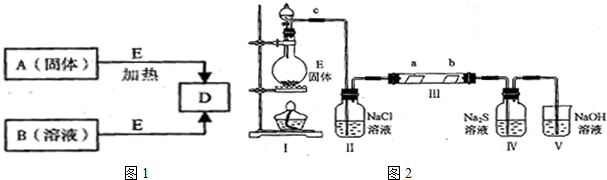
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com