
科目: 来源: 题型:多选题
| A. | 纤维素可以水解生成葡萄糖,因此纤维素属于基本营养物质 | |
| B. | 戊烷(C5H12)有两种同分异构体 | |
| C. | 苯、溴苯、乙醇可以用水鉴别 | |
| D. | 乙醇可以直接氧化成乙酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2:3 | B. | 1:3 | C. | 4:3 | D. | 3:2 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
| 编 号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L(标准状况下) | 2.24L | 4.48L | 6.72L | V |

查看答案和解析>>
科目: 来源: 题型:解答题
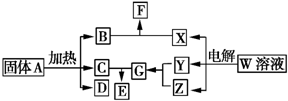 如图所示的无机物的转化关系中,部分生成物和反应条件已略去.其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子.
如图所示的无机物的转化关系中,部分生成物和反应条件已略去.其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子. ;E中含有的化学键类型是离子键和共价键.
;E中含有的化学键类型是离子键和共价键.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
 往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )
往1.0mol•L-1KI溶液中加入固体I2,发生反应:I2(aq)+I- (aq)═I3-(aq)△H;I-的物质的量浓度c(I-)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | a、c两点对应的I-反应速率相等 | |
| C. | b点时0~10s I-的平均反应速率为0.04mol•L-1•s-1 | |
| D. | d点时该反应在对应温度下处于平衡状态 |
查看答案和解析>>
科目: 来源: 题型:选择题
 在密闭容器中通入NO和CO各2mol发生反应:2NO(g)+2CO(g)?2CO2(g)+N2(g).容器内CO2随温度(T)、压强(P)和时间(t)的变化曲线如图所示.以下说法合理的是( )
在密闭容器中通入NO和CO各2mol发生反应:2NO(g)+2CO(g)?2CO2(g)+N2(g).容器内CO2随温度(T)、压强(P)和时间(t)的变化曲线如图所示.以下说法合理的是( )| A. | 温度T2>T1 | B. | 压强P2>P1 | ||
| C. | II曲线表示NO平衡转化率为25% | D. | 该反应的焓变△H<0 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
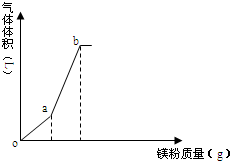 向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )
向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )| A. | o点时,溶液显酸性的主要原因为:NH4++H2O═NH3•H2O+H+ | |
| B. | oa段溶液pH增大,c(NH4+)减小 | |
| C. | b点溶液显中性 | |
| D. | a、b点气体体积比为1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com