
科目: 来源: 题型:解答题
 (其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.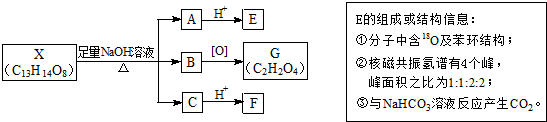
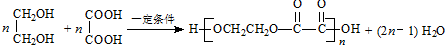 .
.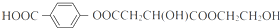 .
.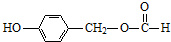 (写结构简式).
(写结构简式).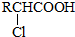
 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
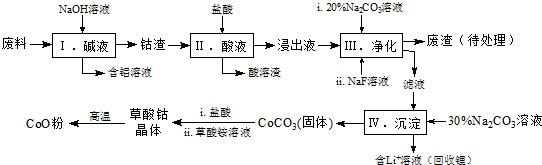
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
 Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].
Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 应用 | 解释 |
| A | 高纯硅作计算机芯片的材料 | 硅晶体在自然界中能稳定存在 |
| B | 在入海口的钢铁闸门上装一定数量的锌块防止闸门被腐蚀 | 利用外加电流的阴极保护法保护金属 |
| C | 高铁车厢采用铝合金材料 | 铝合金强度大,质量轻,不与氧气反应 |
| D | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 其作用是吸收水果释放出的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molNa2O2晶体中阴离子的个数为2NA | |
| B. | 标准状况下,2.24L苯所含的分子总数为0.1NA | |
| C. | 32gO2和32g O3的所含的氧原子数都是为2NA | |
| D. | 6.4g铜与过量的浓硝酸完全反应转移的电子数是0.1NA |
查看答案和解析>>
科目: 来源: 题型:解答题
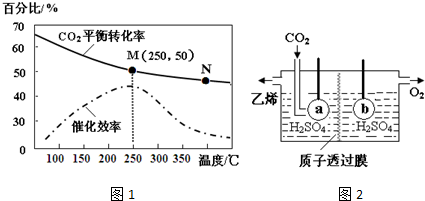
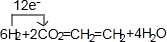 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 14 g C2H4中含有2NA个C-H键 | |
| B. | 1 mol•L-1 NH3•H2O溶液中含有NA个NH4+ | |
| C. | 1 mol Na2O2和足量CO2反应产生NA个O2分子 | |
| D. | 常温常压下,22.4 L 的SO2中含有NA个SO2分子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 100 mL 1 mol•L-1的H2SO4溶液中含有0.1NA个H+ | |
| C. | 将4 g NaOH溶于100 g蒸馏水中,所得溶液物质的量浓度是0.1 mol•L-1 | |
| D. | 20g重水(D2O)所含的电子数为10NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X=0.6mol | |
| B. | 离子的物质的量关系满足n(Cl-)=5n(ClO-)+n(ClO3-) | |
| C. | 若反应中转移的电子为n mol,则有0.3<n<0.5 | |
| D. | ClO3-的物质的量范围是:0.1mol<n(ClO3-)<0.3mol |
查看答案和解析>>
科目: 来源: 题型:解答题
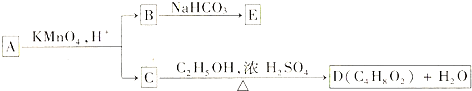
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com