
科目: 来源: 题型:解答题
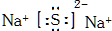 .
.查看答案和解析>>
科目: 来源: 题型:解答题
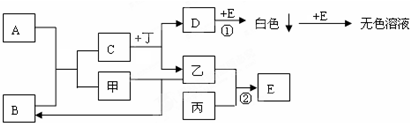
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | pH=10的Na2A溶液中:2 c(Na+)=c(HA-)+c(H2A)+c(A2-) | |
| C. | 等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 氨水和氯化铵的混合溶液,可能会出现c(NH${\;}_{4}^{+}$)>c(Cl-)>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3↑+2 H2O | |
| B. | 用浓盐酸检验氨:NH3+HCl=NH4Cl | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | |
| D. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 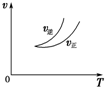 可判断正反应为放热反应 | |
| B. | 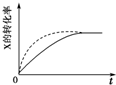 虚线表示可能使用了催化剂或是加压 | |
| C. | 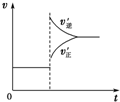 若正反应的△H<0,可表示升高温度使平衡向逆反应方向移动 | |
| D. | 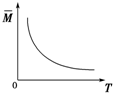 气体平均相对分子质量随温度变化情况,可推知正反应的△H>0 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1NA | |
| D. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
查看答案和解析>>
科目: 来源: 题型:解答题
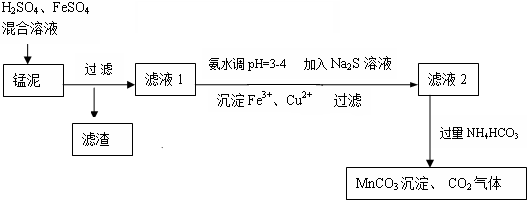
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4L苯含有NA个苯分子 | |
| B. | 0.2 mol•L-1 FeCl3溶液中含有Cl-总数为0.6NA | |
| C. | 在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气 | |
| D. | 4g氦气所含分子数为NA |
查看答案和解析>>
科目: 来源: 题型:解答题
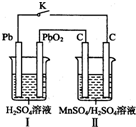 锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为Mn2+-2e-+2H20=MnO2+4H+.
锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为Mn2+-2e-+2H20=MnO2+4H+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com