
科目: 来源: 题型:选择题
| A. | 质子数为53 | B. | 中子数为53 | C. | 质子数为131 | D. | 中子数为131 |
查看答案和解析>>
科目: 来源: 题型:解答题
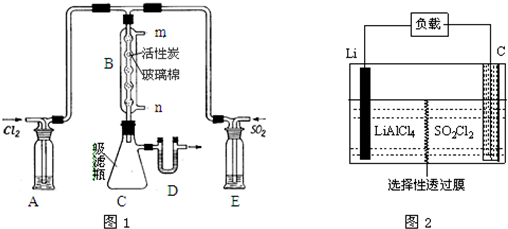
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X | |
| B. | 化合物X2W2、YW2、ZW2等都含有极性共价键和非极性共价键 | |
| C. | 用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时后,在阴极区会出现白色沉淀 | |
| D. | X、Z两元素能形成原子个数比(X:Z)为3:1和2:1的化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 生成42.0L N2(标准状况) | |
| B. | 有0.250mol KNO3被氧化 | |
| C. | 转移电子的物质的量为1.25mol | |
| D. | 被氧化的N原子的物质的量为3.0mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下1L 0.1 mol•L-1 NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1mol H2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | 标准状况下2.24L己烷分子中含有1.9NA对共用电子 | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | PH=11的Na2SO3溶液中,水的电离c( H+)=1.0×10-11mol/L | |
| B. | PH=10的某BOH的碱溶液中加水稀释至100倍,稀释后的溶液中c( OH-)=1.0×10-6mol/L | |
| C. | PH=4的NaHC2O4溶液中存在:c( Na+)>c(HC2O4-)>c( H+)>c(C2O42-)>c( OH-) | |
| D. | PH=2的硝酸与PH=12的氨水等体积混合c( NO3-)>c( NH4+)>c( H+)>c( OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A. | 对应简单离子半径②>⑧>⑨ | |
| B. | 简单氢化物稳定性⑤>⑧ | |
| C. | 最高价氧化物对应的水化物酸性⑨>⑧>⑦ | |
| D. | ①分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com