
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
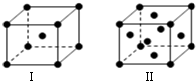 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2. ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
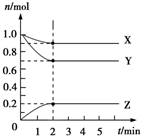 Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 目的 | 操作(文字或图示) | 实验现象 |
| ①催化剂 的影响 | ||
②温度的影响 | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | |
③浓度的影响 | 取两支试管分别加入5mL 5%H2O2溶液和5mL10%H2O2溶液 | 看不到明显的 实验现象 |
查看答案和解析>>
科目: 来源: 题型:解答题
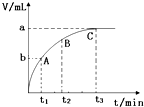 为研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中 | 试管A中不再产生气泡 试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液 | 试管A、B中均未见气泡产生 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯和浓溴水用铁做催化剂制溴苯 | |
| B. | 甲烷与氯气光照制得纯净的一氯甲烷 | |
| C. | 实验室用CaC2和饱和食盐水制备乙炔 | |
| D. | 将苯与浓硝酸混合共热制硝基苯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 四氯化碳可做有机溶剂 | |
| B. | 可用工业酒精勾兑白酒 | |
| C. | 甲烷是清洁高效的燃料 | |
| D. | 用二氯甲烷只有一种结构证明甲烷空间结构是正四面体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在化合物中呈现+2价 | B. | 它的氢氧化物呈两性 | ||
| C. | 原子半径在本族元素中最大 | D. | 单质与水反应能放出氢气 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 用锌和足量稀硫酸制取氢气时加入硫酸铜溶液 | 可以加快制取氢气的速度 | Ⅰ对、Ⅱ对、无 |
| B | 用Mg-Al-NaOH构成原电池 | Mg更活泼作负极 | Ⅰ对、Ⅱ对、无 |
| C | 石墨常用做电解池的电极 | 石墨的化学性质稳定且导电性好 | Ⅰ对、Ⅱ对、有 |
| D | MgCl2是离子化合物 | 电解MgCl2的饱和溶液制取金属镁 | Ⅰ对、Ⅱ对、有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com