
科目: 来源: 题型:解答题
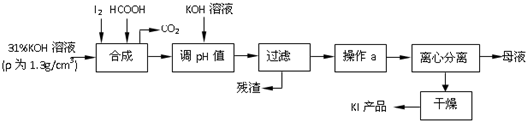
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | PAFC因水解而能净水 | |
| B. | 往甲溶液中滴入KSCN溶液后呈血红色 | |
| C. | 试剂X具有氧化性 | |
| D. | 乙溶液呈酸性 |
查看答案和解析>>
科目: 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化剂与还原剂的质量比为1:2 | |
| B. | NO2是氧化剂水是还原剂 | |
| C. | 生成1molNO则有6mol电子发生转移 | |
| D. | 氧化剂与还原剂的物质的量比为2:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过氧化钠与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 澄清石灰水中通入过量二氧化碳:OH-+CO2═HCO3- | |
| C. | 往FeCl3溶液中加入Cu粉:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | CaCO3溶于稀盐酸中:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
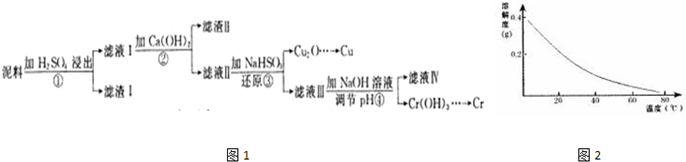 已知:部分物质沉淀的pH如表:
已知:部分物质沉淀的pH如表:| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
科目: 来源: 题型:选择题
 C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )
C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )| A. | 电池放电时,溶液中钠离子向负极移动 | |
| B. | 该电池负极的电极反应为:NaMO2-xe-═Na(1-x)MO2+xNa+ | |
| C. | 消耗相同质量金属时,用锂作负极产生电子的物质的量比用钠时少 | |
| D. | 电池充电时的阳极反应式为:nC+x Na+-xe-═NaxCn |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
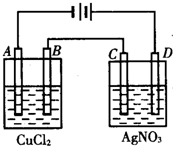 如图为以惰性电极进行电解:
如图为以惰性电极进行电解:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com