
科目: 来源: 题型:解答题
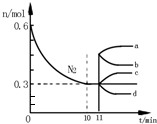 研究氮机器化合物对化工生产有重要意义.
研究氮机器化合物对化工生产有重要意义.| T/℃ | T1 | T2 | T3 |
| K | 10 | 2.5 | 1.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
 一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )
一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )| A. | 该反应在0~8 min内CO2的平均反应速率是 0.375 mol•L-1•min-1 | |
| B. | 若起始时向上述容器中充入3 mol CO2和4 mol H2,则平衡时H2的体积分数大于20% | |
| C. | 若起始时向上述容器中充入4 mol CO2、2 mol H2、2 mol CH3OH和1mol H2O(g),则此时反应向正反应方向进行 | |
| D. | 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气 |
查看答案和解析>>
科目: 来源: 题型:解答题
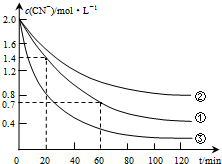 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目: 来源: 题型:解答题
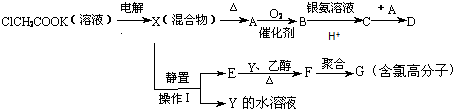
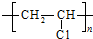 .
. .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 氮分子的电子式 N:::N | B. | 镁原子的原子结构示意图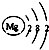 | ||
| C. | 质量数是16的氧原子 ${\;}_{8}^{16}O$ | D. | 乙醇的结构简式 C2H5OH |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知草酸氢钾溶液呈酸性,则在amol•L-1 KHC2O4溶液中,c(C2O42-)<c(H2C2O4) | |
| B. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| C. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% | |
| D. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com