
科目: 来源: 题型:选择题
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58g白色沉淀析出,向所得的浑浊液中,逐渐加入1mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示.则混合物中NaOH质量为( )
把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58g白色沉淀析出,向所得的浑浊液中,逐渐加入1mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示.则混合物中NaOH质量为( )| A. | 3.6g | B. | 4g | C. | 4.4g | D. | 4.8g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,11.2LSO3所含的原子数为1.5NA | |
| B. | 常温常压下,1.8g H2O中含有的电子数为0.8NA | |
| C. | 常温常压下,48g O2和O3的混合物中含有的氧原子数为3NA | |
| D. | 标准状况下,0.1mol Cl2与足量NaOH溶液反应时,转移的电子数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH2═CH2 | B. | CH3CH═CHCH3 | C. | CH3CH═CH2 | D. | CH2═CHCH═CH2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C2H6和C4H10一定是同系物 | |
| B. | C2H4和C4H8一定是同系物 | |
| C. | 相对分子质量相等的两种物质,不一定是同分异构体 | |
| D. | 在常温常压下,C4H10是气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
 天然气在生产、生活中具有广泛的应用.
天然气在生产、生活中具有广泛的应用.查看答案和解析>>
科目: 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2mol H2、l mol CO | 1mol CH3OH | 2mol CH3OH | |
| 平 | c(CH,0H)/mol/L | C1 | C2 | c3 |
| 衡 | 反应的能量变化ZkJ | x | y | z |
| 数 | 体系压强/Pa | P1 | P2 | P3 |
| 据 | 反应物转化率 | a1 | a2 | a3 |
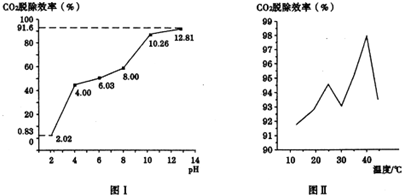
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |

查看答案和解析>>
科目: 来源: 题型:解答题
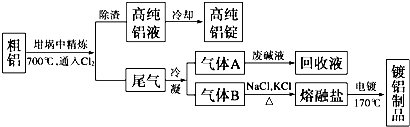
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com