
科目: 来源: 题型:解答题
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中 | 试管A中不再产生气泡 试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液 | 试管A、B中均未见气泡产生 |
查看答案和解析>>
科目: 来源: 题型:解答题
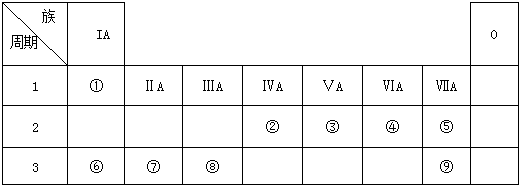
 短周期元素Q、R、T、W在元素周期表中的位置如图:其中T所处的周期序数与主族序数相等,请回答下列问题
短周期元素Q、R、T、W在元素周期表中的位置如图:其中T所处的周期序数与主族序数相等,请回答下列问题查看答案和解析>>
科目: 来源: 题型:解答题
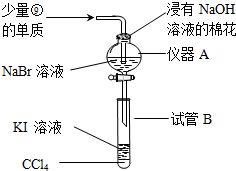
 .
.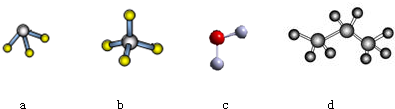
 元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是
元素①和⑨形成的化合物甲中含有共价键键,请用电子式表示物质甲的形成过程是 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
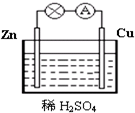 图为原电池的示意图.请回答:
图为原电池的示意图.请回答:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 半径:Al3+>Mg2+>Na+>F- | B. | 稳定性:HI<HBr<HCl<HF | ||
| C. | 酸性:HClO4<H2SO4<H3PO4 | D. | 碱性:Al(OH)3>Mg(OH)2>Ca(OH)2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
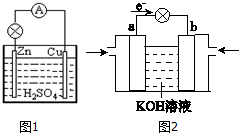 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置.查看答案和解析>>
科目: 来源: 题型:解答题
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4)/mol•L-1 | v(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/S | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com