
科目: 来源: 题型:选择题
| A. | Al13与Al14互为同素异形体 | |
| B. | Al13超原子中Al原子间是通过离子键结合的 | |
| C. | Al14与氢碘酸反应的化学方程式可表示为:Al14+2HI=Al14I2+H2↑ | |
| D. | Al13在一定条件下能和镁作用生成Mg(Al13)2 |
查看答案和解析>>
科目: 来源: 题型:解答题

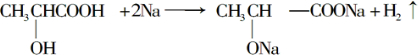 ;
; ;
;查看答案和解析>>
科目: 来源: 题型:解答题


 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. | HO-CH2-CH2OH |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 物质的性质或反应现象 | 原理解释 |
| A | SO2通入溴水,溴水褪色 | SO2有漂白性 |
| B | 碱性:NaOH>Al(OH)3 | 金属性:Na>Al |
| C | 白磷比N2的性质活泼 | 非金属性:P>N |
| D | 少量Na投入CuSO4溶液中,Na可以置换出Cu | 活泼性:Na>Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | +184.6 kJ•mol-1 | B. | -92.3 kJ•mol-1 | C. | +92.3 kJ•mol-1 | D. | +92.3kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com