
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 溶液中的离子反应
溶液中的离子反应查看答案和解析>>
科目: 来源: 题型:填空题
| 试验编号 | 待测液的体积(mL) | 滴入0.4000mol•L-1盐酸的体积(mL) | |
| 滴定前(mL) | 滴定后(mL) | ||
| 1 | 20.00 | 2.10 | 22.00 |
| 2 | 20.00 | 0.90 | 21.00 |
查看答案和解析>>
科目: 来源: 题型:填空题
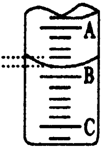 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目: 来源: 题型:解答题



查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
| 实验示意图 | 实验现象 | 解释 |
甲: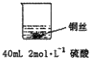 | 无明显现象 | 稀硫酸只能表现酸的氧化性,而铜排在金属活动顺序表氢之后,不能将氢置换出来. |
乙: | 铜丝逐渐溶解,铜丝表面有气泡产生,溶液颜色变蓝 | 稀硝酸是氧化性的酸,能与铜发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O |
查看答案和解析>>
科目: 来源: 题型:填空题
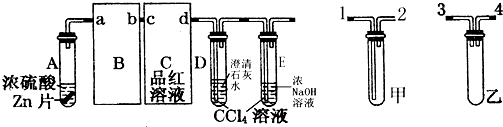
 欲设计一个实验,验证红热的炭与浓硫酸发生反应所生成的各种产物.有一位同学按气体的流动方向设计了一个实验流程,其所使用的试剂顺序可表示为:气体产物→无水硫酸铜固体→品红溶液→酸性高锰酸钾溶液→品红溶液→澄清石灰水.
欲设计一个实验,验证红热的炭与浓硫酸发生反应所生成的各种产物.有一位同学按气体的流动方向设计了一个实验流程,其所使用的试剂顺序可表示为:气体产物→无水硫酸铜固体→品红溶液→酸性高锰酸钾溶液→品红溶液→澄清石灰水.查看答案和解析>>
科目: 来源: 题型:解答题
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.100 0mol•L-1碘的标准溶液,至溶液呈紫色不再褪去,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2S、Na2CO3, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O${\;}_{3}^{2-}$+I2═S4O${\;}_{6}^{2-}$+2I- 产品纯度:$\frac{9}{w}$×100%. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com