
科目: 来源: 题型:选择题
| A. | 硅单质广泛用于制作光导纤维 | |
| B. | SO2使氯水褪色,说明SO2具有漂白性 | |
| C. | 氯气泄漏后应顺风向低处跑 | |
| D. | 酸雨的pH值小于5.6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠、钾着火,应立即用水扑灭 | |
| B. | 燃着的酒精灯打翻失火,应立即用水浇灭 | |
| C. | 蒸发食盐溶液时,发生液滴飞溅现象,应立即加水冷却 | |
| D. | 皮肤上沾有少量浓碱,可立即用大量水冲洗,再涂上3%~5%的硼酸 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
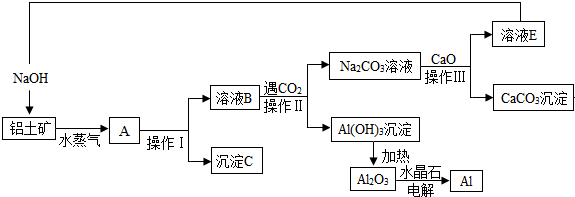
查看答案和解析>>
科目: 来源: 题型:解答题
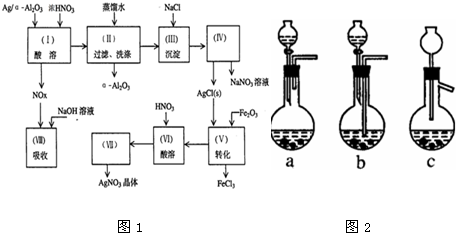
查看答案和解析>>
科目: 来源: 题型:填空题
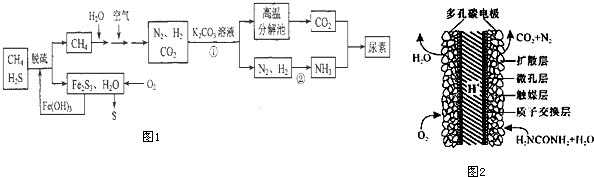
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com