
科目: 来源: 题型:选择题
| A. | 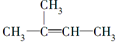 +Br2(CCl4)→ +Br2(CCl4)→ | |
| B. | CH2=CH-CH2-CH3+HCl$→_{△}^{催化剂}$ | |
| C. | CH3-CH=CH2+H2O$→_{加热、加压}^{催化剂}$ | |
| D. | CH4+Cl2$\stackrel{光照}{→}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 最外层电子数为次外层电子数一半的短周期主族元素只有Li、Si两种元素 | |
| B. | 元素周期表中从ⅢB族到ⅡB族之间10个纵行的元素都是金属元素 | |
| C. | 同周期第ⅡA族与第ⅢA族元素的原子序数相差1或11或25 | |
| D. | 若主族元素的族序数为a,周期数为b,当$\frac{a}{b}$<1,该元素为非金属元素 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | |||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
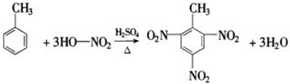

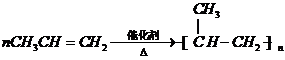
 -CH2CH3+18KMnO4+27H2SO4→5HOOC-
-CH2CH3+18KMnO4+27H2SO4→5HOOC- -COOH+9K2SO4+18MnSO4+5CO2↑+42H2O
-COOH+9K2SO4+18MnSO4+5CO2↑+42H2O查看答案和解析>>
科目: 来源: 题型:解答题
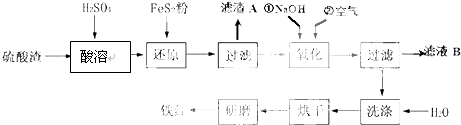
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目: 来源: 题型:填空题
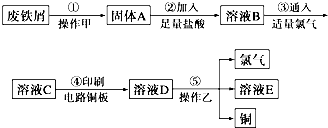
查看答案和解析>>
科目: 来源: 题型:解答题
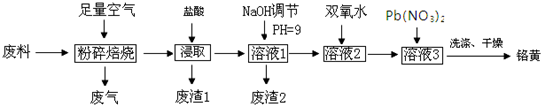
查看答案和解析>>
科目: 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.5 | 8.0 |
| Cu2+ | 5.2 | 6.7 |
| Fe2+ | 5.8 | 8.8 |
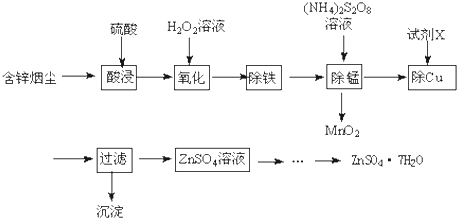
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com