
科目: 来源: 题型:选择题
| A. | 0.4△H1+0.05△H3 | B. | 0.4△H1+0.05△H2 | C. | 0.4△H1+0.1△H3 | D. | 0.4△H1+0.2△H3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高 | |
| D. | 氨气在水中溶解度很大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在元素周期表中,每一列就是一个族 | |
| B. | 主族元素都是短周期元素 | |
| C. | 副族元素都是金属元素 | |
| D. | 元素周期表每个长周期包含32种元素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(l);△H=Q1 2H2(g)+O2(g)=2H2O(g)△H=Q2 | |
| B. | S(g)+O2(g)=SO2(g);△H=Q1 S(s)+O2(g)=SO2(g)△H=Q2 | |
| C. | C(s)+0.5O2(g)=CO(g);△H=Q1 C(s)+O2(g)=CO2(g);△H=Q2 | |
| D. | H2(g)+Cl2(g)=2HCl(g);△H=Q1 0.5H2(g)+0.5 Cl2(g)=HCl(g);△H=Q2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知甲、乙、丙、丁、戊是中学化学中常见的物质,常温下,戊是一种无色无味的液体,它们之间有如下反应关系.
已知甲、乙、丙、丁、戊是中学化学中常见的物质,常温下,戊是一种无色无味的液体,它们之间有如下反应关系.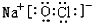 .
.查看答案和解析>>
科目: 来源: 题型:解答题

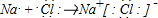
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.2mol | B. | 1.1mol | C. | 1.8 mol | D. | 1.6mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com