
科目: 来源: 题型:解答题
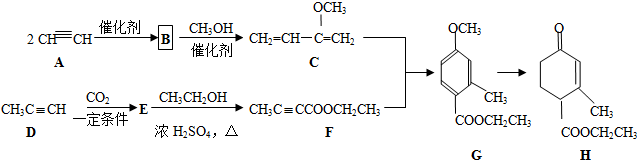
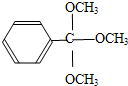 .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
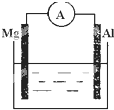 根据所学知识回答下列问题,在如图所示装置中
根据所学知识回答下列问题,在如图所示装置中查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Li、C、O原子最外层电子数依次增加 | B. | P、S、Cl元素最高正化合价依次升高 | ||
| C. | N、O、F原子半径依次增大 | D. | Li、Na、K的金属性依次增强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:Li>Na | B. | 最外层电子数都相同 | ||
| C. | 核外电子层数相同 | D. | 核外电子数相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
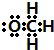 ]-.
]-.查看答案和解析>>
科目: 来源: 题型:填空题
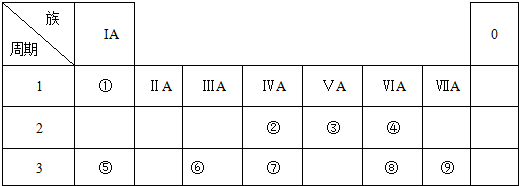
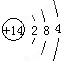 .
.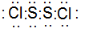 ;A可与水反应生成刺激性气味且能使品红溶液褪色的气体及其他生成物,写出该反应化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.
;A可与水反应生成刺激性气味且能使品红溶液褪色的气体及其他生成物,写出该反应化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com