
科目: 来源: 题型:选择题
| A. | 0.5mol/L | B. | 1mol/L | C. | 2mol/L | D. | 4mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.5Q | B. | 5Q | C. | 2Q | D. | Q |
查看答案和解析>>
科目: 来源: 题型:解答题
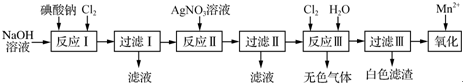
查看答案和解析>>
科目: 来源: 题型:多选题
| 容器 编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CO | H2 | CH3OH(g) | ||
| Ⅰ | T1 | 0.2 | 0.4 | 0.18 |
| Ⅱ | T1 | 0.4 | 0.8 | |
| Ⅲ | T2 | 0.2 | 0.4 | 0.16 |
| A. | 该反应的正反应为放热反应 | |
| B. | 达平衡时,容器Ⅰ中CH3OH(g)的体积分数比容器Ⅱ中的大 | |
| C. | 采取加压、增大c(H2)、加入合适的催化剂等措施,都能提高CO的转化率 | |
| D. | 若起始时向容器Ⅰ中充入CO 0.2 mol、H2 0.2 mol、CH3OH(g)0.5 mol,则反应将向正反应方向进行 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 溶液的浓度变为0.08 mol•L-1 | B. | 阳极上产生112 mL O2(标准状况) | ||
| C. | 转移的电子数是1.204×1022 | D. | 反应中有0.02 mol的Ag被氧化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4C1 | B. | NH4HCO3 | C. | (NH4)2CO3 | D. | (NH4)2SO4 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 ,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com