
科目: 来源: 题型:选择题
 下表为周期表中短周期的一部分.已知a原子的最外层电子数是电子总数的三分之一,下列说法中正确的是( )
下表为周期表中短周期的一部分.已知a原子的最外层电子数是电子总数的三分之一,下列说法中正确的是( )| A. | a的最高价氧化物对应水化物有两性 | |
| B. | b与d组成的化合物不能与水反应 | |
| C. | c的单质能与强碱反应生成两种盐 | |
| D. | c与d能形成共价化合物和离子化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 等体积、等物质的量浓度的氢氧化钙溶液与稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 离子半径:Mg2+>O2->F- | B. | 原子半径:Na>S>O | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验 | 实验目的 |
| A | 钠和镁分别投入冷水中 | 判断钠和镁金属性强弱 |
| B | 在MgCl2与AlCl3溶液中分别加入过量的氨水 | 判断镁与铝的金属性强弱 |
| C | 向硅酸钠溶液中通入CO2 | 判断碳酸与硅酸的酸性强弱 |
| D | Br2与I2分别与足量的H2反应 | 判断溴与碘的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化还原反应均为放热反应 | B. | 放热反应中,反应后体系能量降低 | ||
| C. | 断开化学键的过程会放出能量 | D. | 加热才能发生的反应均为吸热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 每个主族都含有非金属元素 | B. | 构成半导体的元素都是非金属元素 | ||
| C. | 过渡元素都属于金属元素 | D. | 非金属元素都位于短周期 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| B. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 如图表示H2与O2发生反应过程中的能量变化,H2的燃烧热为571.6 kJ•mol-1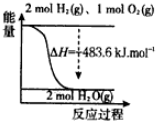 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:填空题
 ,而不排布成
,而不排布成 ,其直接的根据是洪特规则.
,其直接的根据是洪特规则.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com