
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 吸收空气中CO2 所致 | |
| B. | NaOH与玻璃作用,而后吸收CO2 所致 | |
| C. | NaOH中含有Na2CO3 | |
| D. | 溶液中的水分部分蒸发 |
查看答案和解析>>
科目: 来源: 题型:解答题
 某化学兴趣小组用甲、乙两套装置(如图所示)进行甲酸(HCOOH)与甲醇(CH3OH)酯化反应的实验,回答以下问题:
某化学兴趣小组用甲、乙两套装置(如图所示)进行甲酸(HCOOH)与甲醇(CH3OH)酯化反应的实验,回答以下问题:查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.
A、B、C、D、E原子序数依次增大,且为前四周期的元素,其中B2-和C+具有相同的核外电子排布;D的氢化物的沸点比其上一周期同族元素氢化物的沸点低;E核外有五个单电子,B、E形成的某种化合物和A、D形成的化合物的浓溶液加热时反应可用于实验时制取气态单质D.查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,向20mL 0.1mol•L-1 CH3COOH溶液中加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下,向20mL 0.1mol•L-1 CH3COOH溶液中加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a和b之间的溶液中只存在:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | b与c之间的溶液中不存在:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| C. | c点时,V(NaOH溶液)<20mL,且c(CH3COO-)=c(Na+) | |
| D. | a、b、c点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$均相等 |
查看答案和解析>>
科目: 来源: 题型:解答题
 R、X、Y、Z是位于前四周期的元素,基态R原子核外电子占据3个能级,且每个能级上电子数相等,Y、X能组成两种阳、阴离子个数比为1:1、2:1型化合物.ZX2是常见的催化剂、氧化剂和电极材料,R、X、Y组成一种常见化合物,其水溶液常用于餐具的洗涤剂.R、X、Y原子的质子数之和等于Z的质子数.
R、X、Y、Z是位于前四周期的元素,基态R原子核外电子占据3个能级,且每个能级上电子数相等,Y、X能组成两种阳、阴离子个数比为1:1、2:1型化合物.ZX2是常见的催化剂、氧化剂和电极材料,R、X、Y组成一种常见化合物,其水溶液常用于餐具的洗涤剂.R、X、Y原子的质子数之和等于Z的质子数.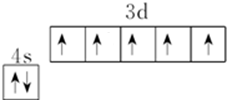 ;上述四种元素中,第一电离能最小的元素的基态原子核外有11种不同的电子运动状态.
;上述四种元素中,第一电离能最小的元素的基态原子核外有11种不同的电子运动状态.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,48g O3含有的氧原子数为3NA | |
| B. | 17g的OH-离子中含有的电子数为0.1NA | |
| C. | 常温常压下,11.2L氧气中所含有的原子数为NA | |
| D. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com