
科目: 来源: 题型:填空题
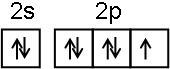 ;NF3中心原子轨道的杂化类型为sp3.
;NF3中心原子轨道的杂化类型为sp3.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 2s22p3和2s22p4 | B. | 3s23p4和2s22p4 | C. | 3s2和2s22p3 | D. | 3s23p1和3s23p4 |
查看答案和解析>>
科目: 来源: 题型:解答题
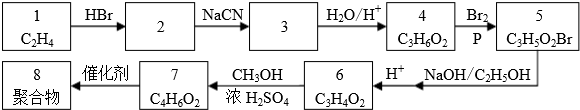
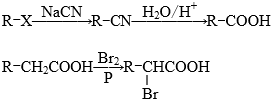
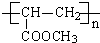 .
.查看答案和解析>>
科目: 来源: 题型:解答题
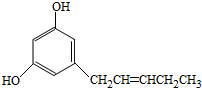
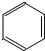 都是平面型分子
都是平面型分子查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
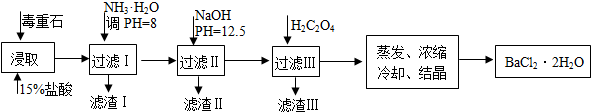
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目: 来源: 题型:解答题
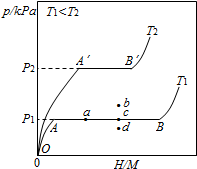 合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.查看答案和解析>>
科目: 来源: 题型:解答题
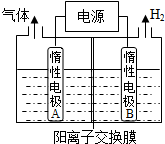 利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.
利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.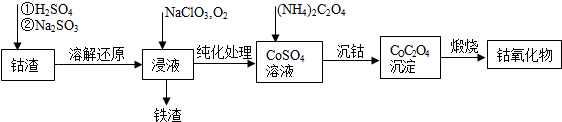
查看答案和解析>>
科目: 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | Br-还原性强于Cl- |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AlCl3 | B. | Na2O | C. | FeCl2 | D. | SiO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com