
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
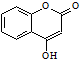 是一种医药中间体.常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体.常用来制备抗凝血药,可通过下列路线合成:

 和乙醇为原料,制备
和乙醇为原料,制备  的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$ CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$ CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.查看答案和解析>>
科目: 来源: 题型:解答题
 b.
b. c.
c.
 b.
b. c.CH3OCH3
c.CH3OCH3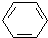 b.
b. c.
c.
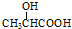 )有良好的防腐保鲜功效,广泛应用于食品行业.
)有良好的防腐保鲜功效,广泛应用于食品行业.
 ,
, .
.查看答案和解析>>
科目: 来源: 题型:解答题
 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:| 操作 | 现象和结论 |
| ①取-定量2mol/L NaCl溶液,调 节溶液pH为4.91:再以相间装置进行电解. ②电解相同时间后,若电极b表面无气泡,取少量阳极附近的溶液,滴入淀粉KI溶液 | |
查看答案和解析>>
科目: 来源: 题型:解答题
 O3氧化海水中I-是大气中碘的主要来源.将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,发生反应如下:
O3氧化海水中I-是大气中碘的主要来源.将O3通入稀硫酸酸化的NaI溶液中进行模拟研究,发生反应如下: .
.| 实验编号 | 实验目的 | 反应物 | 温度 | 反应前溶液的pH |
| A | 对照组 | O3+NaI+H2SO4 | 25℃ | 5.2 |
| B | 研究FeCl2对I3-生成速率的影响 | O3+NaI+H2SO4+FeCl2 | 25℃ | 5.2 |
| C | 研究温度对I3-生成速率的影响 | O3+NaI+H2SO4 | 5℃ | 5.2 |
查看答案和解析>>
科目: 来源: 题型:解答题

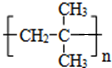 .
.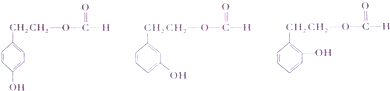 .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
 .
.| 电负性 | 熔沸点 | 稳定性 | 酸性 |
| O>N | NH3>PH3 | Fe2+< Fe3+ | H3PO4<HNO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
 常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )| A. | a点时升高温度,溶液pH增大 | |
| B. | b点c(CH3COO-)<c(CH3COOH) | |
| C. | c点对应的NaOH溶液的体积V=20mL | |
| D. | d点c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 配制0.1mol•L-1莫尔盐溶液500mL,需莫尔盐19.6克 | |
| B. | 可与含Fe2+、HClO、H+、Cl-微粒的溶液大量共存 | |
| C. | 加入过量Ba(OH)2溶液发生反应:2Ba2++2SO42-+Fe2++2OH-=2BaSO4↓+Fe(OH)2↓ | |
| D. | 取样,加入浓NaOH溶液并加热,出现可让蓝色石蕊试纸变红的气体,证明含NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com