
科目: 来源: 题型:解答题

| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
查看答案和解析>>
科目: 来源: 题型:解答题
 已二酸是一种重要的有机二元酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备.反应原理:3
已二酸是一种重要的有机二元酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备.反应原理:3 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH2)4COOH+8NO↑+7H2O,反应装置(部分夹持装置和热源已省略)如图所示.
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH2)4COOH+8NO↑+7H2O,反应装置(部分夹持装置和热源已省略)如图所示.查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
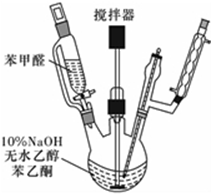
 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表).其实验步骤为:
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表).其实验步骤为:| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量;O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量;O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:查看答案和解析>>
科目: 来源: 题型:解答题
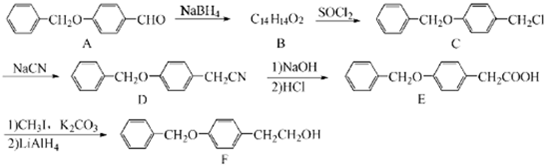
 ;由C→D的反应类型是:取代反应.
;由C→D的反应类型是:取代反应. .
. 为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO$→_{催化剂△}^{O_{2}}$CH3COOH$→_{浓硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO$→_{催化剂△}^{O_{2}}$CH3COOH$→_{浓硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:多选题

| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y中不含有手性碳原子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 | |
| B. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 | |
| C. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 | |
| D. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com